Bakterier fanns i årtusenden före människan och har infekterat oss från början. Även om vi kan behandla infektioner med läkemedel, fortsätter bakterier att bli resistenta mot behandling tack vare deras snabba utveckling. Bakterieinfektioner är fortfarande en ledande orsak till sjuklighet och dödlighet 2024, vilket resulterar i nästan åtta miljoner årliga dödsfall globalt.
En nyckelegenskap som delas av alla smittsamma bakterier kallas kemotaxi. Kemotaxi är en mångsidig process som tillåter bakterier att simma mot energirika molekyler, hitta föredragna nischer för infektion, undvika skadliga arter, ändra hastigheter och helt sluta för att bilda biofilmer. Kemotaxi är också avgörande för virulens hos djur och ett potentiellt mål för nya terapier. Men först måste själva processen förstås bättre.
Labbet av Tina Iverson, Louise B. McGavock Professor och professor i farmakologi, i samarbete med forskare vid University of California, San Francisco; Stanford University; och Weizmann Institute of Science i Israel har publicerat nytt arbete i Nature Microbiology , som ger nya insikter om kemotaxi.
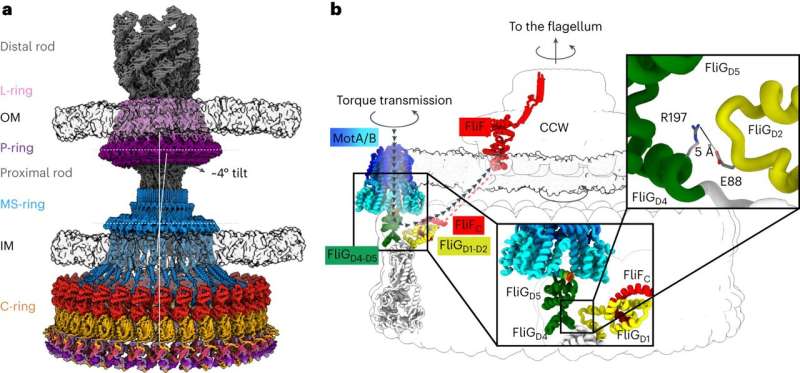
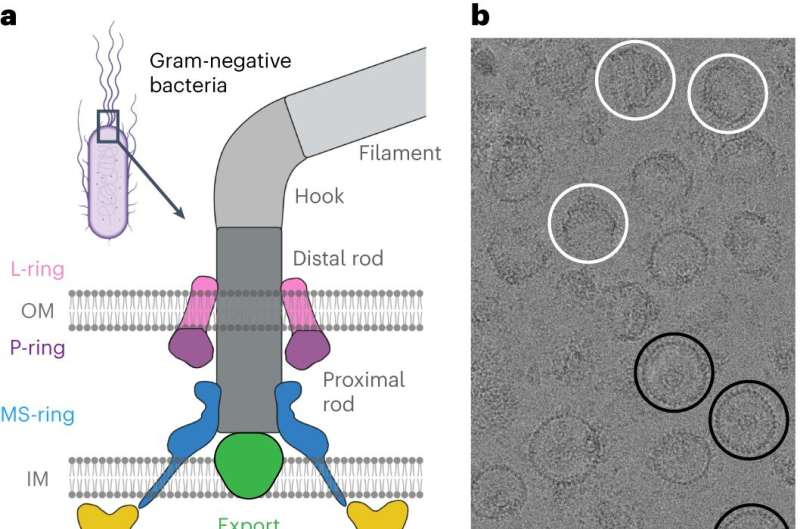
Kemotaxi kräver en liten motor för att vrida ett flagellum - ett hårliknande bihang på bakterier som snurrar för att ge framdrivning, som en båtmotor. Att rotera flagellen medurs eller moturs i olika hastigheter gör att bakterier kan röra sig mot eller bort från olika stimuli. Aktuell forskning har inte kommit fram till en överenskommen arkitektur för de centrala komponenterna i motorn som driver flagellumet, vilket har hindrat forskarnas förståelse för och förmåga att rikta kemotaxi med läkemedel.
Det aktuella arbetet, som leds av senior forskarassistent vid Iverson-labbet Prashant Singh, lägger fram ny information om hur en motorkomponent som kallas en strömbrytare reverserar rotation och överför vridmoment till flagellumet.
För att göra detta tittade forskarna på Salmonella enterica, en bakterie som ansvarar för cirka 60 000 dödsfall globalt per år, som en modell. Efter att ha isolerat och renat S. enterica-motorer som stabiliserats i olika simkonfigurationer, utnyttjade kollaboratörerna kraften i Vanderbilts Titan Krios, ett kryoelektronmikroskop på 10 miljoner dollar som förvärvats av School of Medicine Basic Sciences som gjordes tillgängligt genom Center for Structural Biologys Cryo -EM-anläggning.
Strukturerna gav forskarna information om hur den bakteriella motorn driver medurs och moturs rotation av flagellumet, vilket gör att en bakterie kan simma rakt eller byta riktning under simning. Det hjälpte dem också att förstå hur proteiner binder till motorn för att hjälpa till att reglera bakterierörelser.
Dessa resultat är tillämpliga på ett brett spektrum av infektioner. Till exempel är Salmonella kemotaximaskineriet nästan identiskt med det hos Escherichia coli, som är ansvarigt för över 250 000 infektioner per år enbart i USA. Eftersom kemotaxi krävs för infektion, kan en selektiv störning av interaktionerna som gör att patogener kan bilda en reservoar i en organism bidra till att förhindra återkommande infektioner utan att påverka den normala mikrobiomet.
Iverson-labbet arbetar nu med att identifiera hur ett utökat utbud av olika proteinpartners binder till flagellmotorn under kemotaxi, och hoppas att detta kommer att leda till sätt att störa kemotaxi under infektion.
Mer information: Prashant K. Singh et al, CryoEM-strukturer avslöjar hur det bakteriella flagellumet roterar och byter riktning, Nature Microbiology (2024). DOI:10.1038/s41564-024-01674-1
Journalinformation: Naturmikrobiologi
Tillhandahålls av Vanderbilt University