Att observera proteiner exakt inuti celler är extremt viktigt för många forskningsgrenar men har varit en betydande teknisk utmaning – särskilt i levande celler, eftersom den erforderliga fluorescerande märkningen måste fästas individuellt till varje protein.
Forskargruppen ledd av Stefan Kubicek vid CeMM har nu övervunnit detta hinder:Med en metod som kallas "vpCells" är det möjligt att märka många proteiner samtidigt, med hjälp av fem olika fluorescerande färger. Denna automatiserade metod för hög genomströmning, med hjälp av AI-stödd bildigenkänning, öppnar upp för helt nya tillämpningar inom olika discipliner, från grundläggande cellbiologi till läkemedelsupptäckt. Studien har publicerats i tidskriften Nature Cell Biology .
Utan proteiner skulle livet som vi känner det vara otänkbart. De tillhandahåller det strukturella ramverket för celler, fungerar som enzymer för att kontrollera ämnesomsättningen och gör det möjligt för celler att kommunicera med sin omgivning som membranreceptorer, transportörer eller signalmolekyler. Alla dessa funktioner kan bara uppfyllas om proteinerna är placerade på rätt plats i cellen. Ofta ändras till och med egenskaperna hos ett protein när det ändrar sin plats – kontroll över dess lokalisering i cellen innebär därför också kontroll över dess funktion.
För att förstå och utforska proteiners funktion är det viktigt att exakt bestämma och spåra deras plats i cellen. Proteiner pendlar ofta dynamiskt mellan olika organeller och avdelningar i cellen. För att visualisera dem under mikroskopet är de ofta kopplade till en fluorescerande, starkt lysande proteinkomponent. Denna metod har dock haft tekniska svårigheter:Vanligtvis kunde den fluorescerande komponenten bara fästas till ett protein åt gången, och för att märka flera proteiner måste celler vanligtvis dödas och fixeras.
Den nya metoden som presenteras av Stefan Kubiceks grupp, kallad "visual proteomics Cells" (förkortad vpCells), gör att proteiner kan fluorescensmärkas på ett sätt som bevarar deras endogena regleringsmekanismer. Istället för att märka ett protein i taget kan vpCells fusionera många proteiner samtidigt med en fluorescerande tagg i en så kallad multiplexansats.
En föregångare till denna metod beskrevs redan av Kubiceks team 2020 för att studera metaboliska enzymer. Nu har den utökats och förbättrats på tre sätt:
För det första kan vpCells märka alla teoretiskt möjliga proteiner med hjälp av CRISPR/Cas9-genredigeringsverktyget för att genetiskt fästa fluorescerande proteiner till proteinerna som undersöks. Kubiceks grupp har skapat ett genomomfattande "bibliotek" för detta ändamål, vilket möjliggör fluorescerande märkning och systematisk funktionell utforskning av alla möjliga mänskliga proteiner.
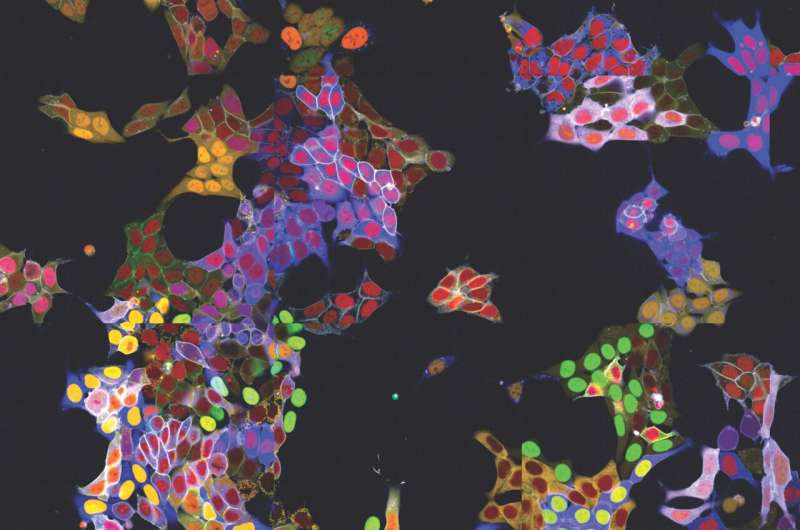
För det andra använder vpCells inte bara en fluorescerande färg utan totalt fem komplementfärger. I varje cell markeras två olika proteiner som ska spåras. Dessutom används en annan färgmarkering för att bättre särskilja enskilda kloner. Och ytterligare två färger markerar cellkärnan och membranet för att avgränsa enskilda celler bättre.
För det tredje möjliggör detta färgschema inte bara att generera visuellt tilltalande bilder, utan också att optiskt känna igen och särskilja de olika proteinerna. Normalt kräver detta komplex DNA-sekvensering efter bildbehandling för att bestämma vilket protein som är märkt. vpCells tillvägagångssätt, å andra sidan, gör det möjligt att träna ett AI-assisterat bildigenkänningssystem för att känna igen vilket protein som är markerat i vilken cell baserat enbart på fluorescensmikroskopbilder.
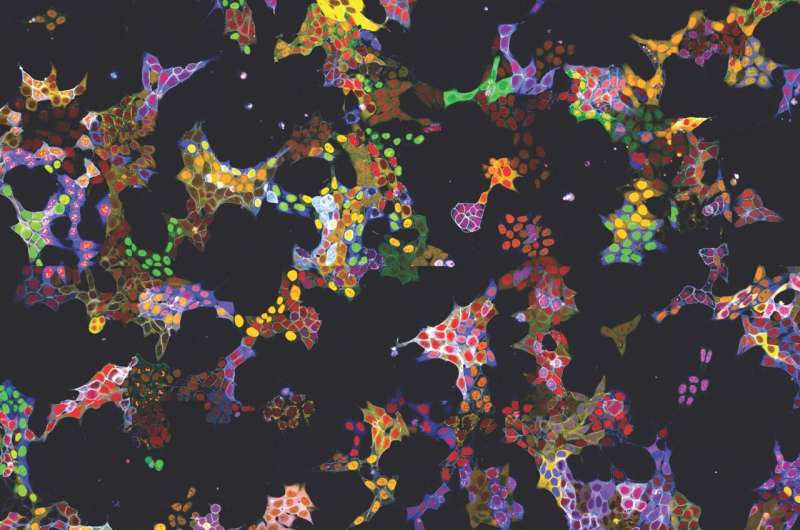
Metoden har redan visat sin användbarhet i två tillämpningar:Å ena sidan genererades mer än 4 500 cellinjer som reportrar för mer än 1 100 proteiner. Dessa cellinjer användes för att träna AI-modellerna och för att beskriva lokalisering av proteinerna i deras basala tillstånd. Alla bilder av de individuella märkta proteinerna är tillgängliga på den allmänt tillgängliga webbdatabasen vpCells.
Å andra sidan användes de levande reportercellerna för en specifik forskningsfråga:Kubiceks team undersökte effekten av mer än 1000 småmolekylära ämnen på 61 proteiner som är relevanta för cancerceller. Forskarna fann att 44 av de testade substanserna förändrade mängden eller lokaliseringen av enskilda proteiner inom 6 timmar. Ett av ämnena visade sig vara en hämmare av proteintransport från cellkärnan, som har en liknande effekt som ett kliniskt godkänt läkemedel mot multipelt myelom, en cancer i det blodbildande systemet.
"Dessa resultat ger en första inblick i vpCells-metodens mångsidighet", säger Kubicek. "Vi förväntar oss många fler framtida tillämpningar, från grundläggande cellbiologi till tillämpad läkemedelsupptäckt."
Mer information: Poolad flerfärgstaggning för att visualisera subcellulär proteindynamik, Nature Cell Biology (2024). DOI:10.1038/s41556-024-01407-w
Journalinformation: Naturcellbiologi
Tillhandahålls av CeMM Research Center for Molecular Medicine vid den österrikiska vetenskapsakademin