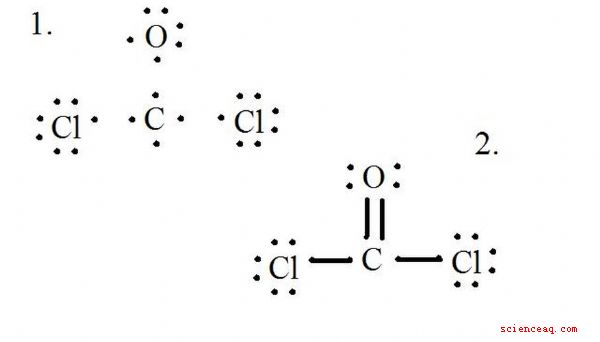
När du bestämmer den formella laddningen för en molekyl såsom CoCl2 (fosgengas), behöver du veta antalet valenselektroner för varje atom och molekylens Lewis-struktur.
Valence Electron Number
Se upp varje atom i det periodiska elementets tabell för att bestämma antalet valenselektroner.
Kom ihåg att två elektroner går i det första s-skalet, två elektroner i det andra s-skalet, sex elektroner i det första p-skalet, etc. Som en påminnelse: 1s (^ 2) 2s (^ 2) 2p (^ 6) 3s (^ 2) 3p (^ 6)
Justera för laddning. Om molekylen är en jon, lägg till eller subtrahera en eller flera elektroner totalt för att ta hänsyn till slutladdningen.
För CoCl2 (fosgengas): C = 4; O = 6; Cl = 7. Molekylen är inte joniserad och har en neutral laddning. Därför är den totala mängden valenselektroner 4 + 6 + (7x2) = 24.
Lewis Structure
Se diagrammet för Lewis-strukturen för CoCl2 (fosgengas). Lewisstrukturen representerar den mest stabila och sannolika strukturen för en molekyl. Atomer ritas med parade valenselektroner; bindningar bildas mellan ensamma elektroner för att tillfredsställa oktettregeln.
Rita varje atom och dess valenselektroner, bild sedan obligationer efter behov.
Kloridatomerna delar enskilda bindningar med kolmolekylen, medan syreatomen bildar en dubbelbindning med kol. Varje atom i den slutliga strukturen uppfyller oktettregeln och har åtta valenselektroner som möjliggör molekylär stabilitet.
Formell laddning av varje atom
Räkna de ensamma paren i varje atom i Lewis-strukturen. Tilldela varje atom en elektron från varje bindning där den deltar. Lägg till dessa nummer tillsammans. I CoCl2: C = 0 lone par plus 4 elektroner från bindningar = 4 elektroner. O = 4 elektroner från ensamma par plus 2 elektroner från obligationer = 6 elektroner. Cl = 6 elektroner från ensamma par plus 1 elektron från ett bindemedel med C = 7 elektroner.
Subtrahera summan från antalet valenselektroner i den obundna atomen. Resultatet är den formella avgiften för den atomen. I CoCl2: C = 4 valenselektroner (v.e.) i obunden atom minus 4 tilldelade elektroner i Lewis struktur (L.s.) = 0 formell laddning O = 6 v.e. - 6 L. = 0 formell laddning Cl = 7 v.e. - 7 L. = 0 formell laddning
Skriv dessa laddningar bredvid atomerna i Lewis-strukturen. Om den totala molekylen har en laddning, sätt in Lewis-strukturen i parentes med laddningen skriven utanför parentesen i övre högra hörnet.
Varning
Beräkning av formeln för molekyler som innehåller övergångsmetaller kan vara knepig. Antalet valenselektroner för övergångsmetaller kommer att vara de som ligger utanför den ädelgasliknande kärnan.