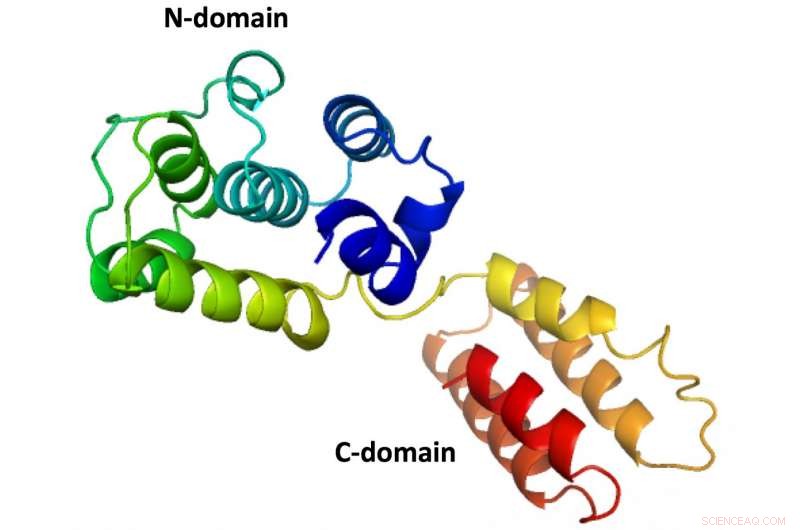
Den första kompletta strukturen för ett M1 -protein från ett infektiöst laxanemi -virus, som avslöjats av forskare vid Rice University. Proteinets struktur, som bildar en skyddande sköld runt virusinnehållet, liknar influensavirus som infekterar människor, men inga strukturer för dem har producerats som visar både N- och C -domänerna. Kredit:Tao Laboratory/Rice University
Strukturen hos en proteinnyckel för överlevnad och spridning av ett virus som påverkar lax kan ge information om strategier för att behandla influensa hos människor, enligt forskare vid Rice University.
Rice-labbet av strukturbiologen Yizhi Jane Tao producerade den första fullängdsstrukturen av matrisproteinet som finns i ett ortomyxovirus som orsakar anemi hos atlantlax. Eftersom proteinets struktur och funktion är så lik det som hittills har hittats i influensavirus, Tao förväntar sig att de kommer att vara användbara för att bestämma mekanismerna för mänskliga virus också.
"Detta virus och alla influensavirus tillhör samma familj, så de samlas på ett mycket liknande sätt, ", sa hon. "Även om detta protein är från ett fiskinfekterande virus, det kommer att ge oss insikt om hur matrisproteinerna stödjer sammansättningen av andra virus."
Upptäckten är detaljerad denna månad i Proceedings of the National Academy of Sciences .
Taos laboratorium specialiserar sig på röntgenkristallografi och andra tekniker för att avslöja de grundläggande strukturerna för molekyler som det sköra matrisproteinet som kallas M1. Många försök att definiera den fullständiga strukturen har misslyckats eftersom proteinet har två huvudsektioner:N- och C-domänerna.
Eftersom den tunna restresten som håller ihop domänerna faller isär så lätt, Forskare har hittills bara kunnat fånga N-domänstrukturer genom kristallisering.

En tredimensionell återgivning av strukturen hos det infektiösa laxanemiviruset. Återgivningen visar, från toppen, det svampformade glykoproteinet, det yttre membranbladet, det inre membranbladet och matrisproteinskalet. Rice University forskare har fått den fullständiga strukturen av proteiner som utgör det inre skalet. Kredit:Tao Laboratory/Rice University
M1 kan vara ömtålig på egen hand, men det blir ett tufft skal när det binder med andra M1 -proteiner för att bilda en sfärisk eller rörformig matris som inkapslar och skyddar det virala RNA. Denna matris sitter precis inuti ett lipiddubbelskikt, virusets yttre hölje som innehåller långa glykoproteiner. Dessa glykoproteiner söker efter och fäster vid målceller med sina ektodomän, medan deras cytoplasmatiska svansar fungerar som en brygga till N-domänen av matrisproteinet. C-domänen pekar inåt från matrisen och är en brygga till virusmängden inuti.
"M1 hjälper till att stödja formen, ", sade Tao. "Det är en viktig funktion för något matrisprotein. Matrisen hjälper också till att införliva det virala RNA:t. Förmodligen, om det inte finns något matrisprotein, du slutar med en tom vesikel."
Den armbågsformade strukturen hos M1 som finns i det infektiösa laxanemiviruset har sex tätt packade alfaspiraler som utgör N-domänen och liknar dem som finns i stammar av influensa A. På andra sidan av det flexibla gångjärnet, armbågen, " ligger C-domänen med fyra alfa-helixar. Båda domänerna har hydrofoba kärnor för att stabilisera dem runt gångjärnet som kan variera med så mycket som 40 grader.
Tao sa att att ha proteinets fullständiga struktur kommer att hjälpa forskare att avgöra hur det och andra liknande det polymeriserar till ett skyddande skal och associerar med membranet. "Att känna till strukturen för endast en domän, vi kunde inte förstå hur matrisproteiner interagerade med varandra för att bilda skalet, " sa hon. "Interaktionen involverar båda domänerna."

En kryoelektrontomografibild av det infektiösa laxanemiviruset visar detaljer om dess struktur, inklusive det inre matrisproteinskalet. Rice University forskare har nu fått den fullständiga strukturen av proteiner som utgör det inre skalet. Kredit:Tao Laboratory/Rice University
Hon sa att den fullständiga strukturen också kan ge ledtrådar för framtida antivirala medel mot influensa. En behandling som adresserar M1 skulle behöva hitta och invadera de virusinfekterade cellerna.
"Men om det finns en kemikalie som kan avbryta självassociationen av M1-proteiner, det kommer att vara väldigt användbart, " sa Tao. "Jag tror inte att det spelar någon roll vilken domän den binder, så länge det hindrar skalet från att bildas. Detta kan vara ett giltigt mål. "