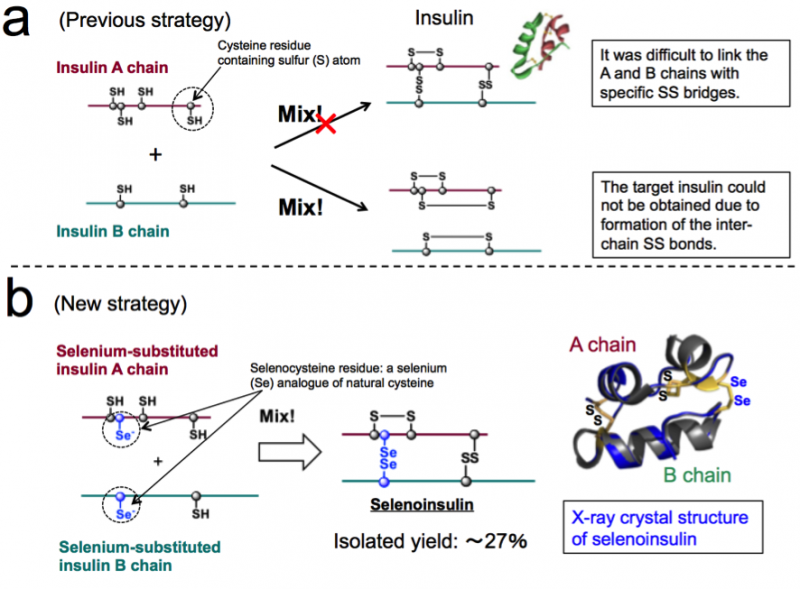
Figur 1. Kemisk syntes av insulin. (a) Tidigare strategi baserad på kopplingen mellan nativa insulin A- och B-kedjor. (b) Ny strategi som utnyttjar selenocystein unika karaktär och röntgenkristallstruktur av selenoinsulin. (Dessa siffror är citerade från den ursprungliga artikeln med ändringar.). Upphovsman:Osaka University
En grupp forskare har utvecklat syntetiska insulinanaloger selenoinsulin (Se-Ins) genom att ersätta interkedjedisulfiden i bovint pankreasinsulin (BPIns) med en diselenidbrygga.
Denna grupp visade att Se-Ins hade en nästan identisk struktur och bioaktivitet jämförbar med BPins, och att det hade ökat motstånd mot IDE -nedbrytning. Detta lovar att applicera Se-Ins på ett långvarigt insulinpreparat vid diabetesbehandling.
Efter cirkulation i blodet, insulin bryts ner av ett insulinnedbrytande enzym (IDE) i njurarna och utsöndras i urinen. Denna grupp trodde att produktion av insulin med hög resistens mot nedbrytning av IDE skulle leda till utvecklingen av en ny typ av långvariga insulinpreparat som skulle kunna cirkulera i kroppen under lång tid.
Insulin består av två polypeptidkedjor:En kedja och B -kedja, ansluten med en disulfidbindning (Se -Se -bindning), så det är svårt att bara ta insulin från dessa kedjor på grund av Se -Se -bindningar. Således, denna grupp trodde att om insulin A-kedjor och B-kedjor innehåller selen (Se) istället för svavel (S), var använda, diselenidbindningen (Se-Se-bindningen) skulle bildas snabbt och sedan kunde kedjesamlingsreaktionen utföras effektivt, eftersom Se är mer reaktiv än S.
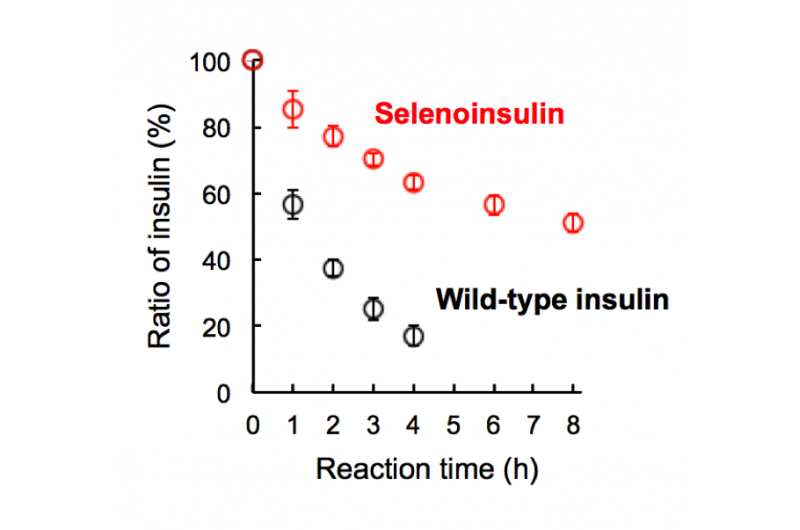
Figur 2. Nedbrytning av selenoinsulin (rött) och vildtypinsulin (svart) av insulinnedbrytande enzym (IDE). (Denna siffra citerades från den ursprungliga artikeln med små ändringar.). Upphovsman:Osaka University
Dessutom, Se-Se-obligationer är mer stabila än SS-obligationer, så denna grupp förutsåg att Se-Se-bindningar skulle ge extra strukturell robusthet på insulinvecket, vilket resulterar i ökat motstånd mot IDE -nedbrytning på grund av dess inneboende stabilitet. Baserat på detta koncept, denna grupp lyckades med syntesen av Se-innehållande insulin A- och B-kedjor, samt erhålla Se-Ins vid isoleringsutbytet på upp till 27% genom att reagera peptidkedjor under optimala förhållanden.
Denna grupp visade att Se-Ins hade en nästan identisk struktur som BPIns, vilket tyder på att Se-Ins har en bioaktivitet som är jämförbar med BPIns. Experiment med nedbrytning av BPIns och Se-Ins med användning av IDE visade att nedbrytningshastigheten för Se-Ins var mycket långsammare än BPIns. Från detta, man tror att Se-Ins har en långvarig natur och kan vara en ny klass med långverkande insulinanaloger för diabetesbehandling.
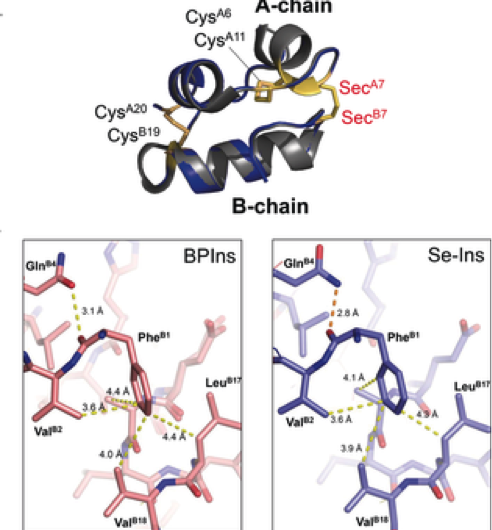
Figur 3. Beredning av Selenoinsulin som en långvarig insulinanalog. Upphovsman:Osaka University