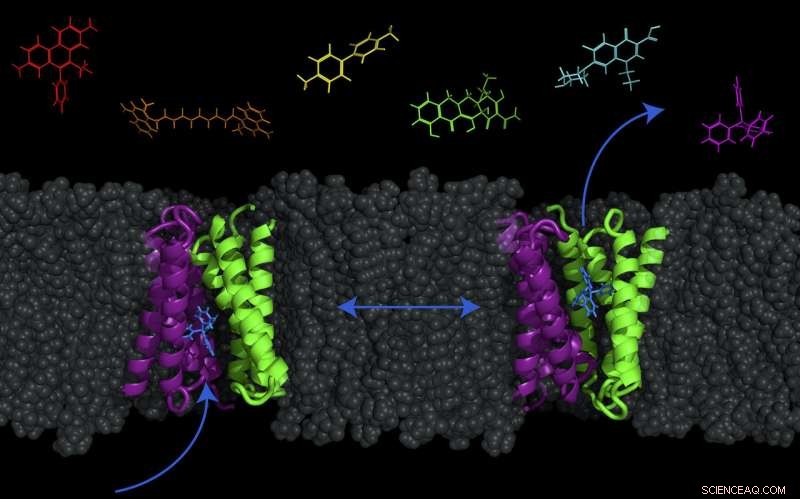
Ett transportprotein - kallat EmrE, visas i lila och grönt -- i cellmembranet hos E. coli kan bakterier växlas mellan två konformationer för att pumpa molekyler (som antibakteriella läkemedel) ut ur eller in i cellen. Kredit:Katherine Henzler-Wildman/UW-Madison.
Forskare vid University of Wisconsin-Madison Department of Biochemistry har upptäckt att en cellpump som är känd för att flytta läkemedel som antibiotika ut ur E. coli-bakterier har potential att ta in dem också, öppnar nya forskningslinjer för att bekämpa bakterierna.
Upptäckten skulle kunna skriva om nästan 50 års funderingar kring hur dessa typer av transportörer fungerar i cellen.
Celler måste ta in och ta bort olika material för att överleva. För att åstadkomma detta, de använder olika transportproteiner i sina cellmembran, varav de flesta drivs av vad som kallas protonens drivkraft. Protonens drivkraft riktas mot insidan av cellen i bakterier, vilket innebär att protoner naturligt vill flytta in i cellen utifrån och gör det om det finns en väg för dem. Dessa transportörer tillåter den uppmätta rörelsen av protoner in i cellen - och i utbyte mot att protoner rör sig in, läkemedelsmolekyler drivs ut.
Man trodde länge att detta kopplade utbyte av protoner (in) och droger (ut) av transportören var mycket strikt. Dock, i en studie publicerad idag (7 november, 2017) i tidskriften Proceedings of the National Academy of Sciences , UW-Madison biokemiprofessor Katherine Henzler-Wildman och medarbetare vid Washington University School of Medicine i St. Louis har funnit att för E. colis lilla multiresistenstransportör, kallas EmrE, proton- och drogrörelser är inte lika strikt kopplade. Denna transportör kan faktiskt också flytta läkemedel och protoner över membranet i samma riktning, såväl som den motsatta riktningen – att införa möjligheten att flytta molekyler både in i eller ut ur cellen.
Denna mindre detalj har stora konsekvenser, säger forskarna. De modeller som forskare har använt i nästan 50 år för att visualisera hur dessa transportörer fungerar tar inte hänsyn till de nya uppgifterna. Det betyder också att det kan vara möjligt för läkemedel att pumpas in i cellen.
"De långsiktiga konsekvenserna är att denna multidrogtransportör är reversibel, " säger Henzler-Wildman. "Så istället för att pumpa ut droger för att ge resistens, du har möjligheten att du kan använda den för att pumpa in droger för att döda bakterier. Intrång av droger är ett stort problem, så det här är ett nytt område att utforska."

Biokemiprofessor Henzler-Wildman vid National Magnetic Resonance Facility i Madison, inrymt i UW-Madisons institution för biokemi. Kredit:UW-Madison/ Robin Davies
Hon tillägger att denna studie och hennes tidigare arbete tyder på att genom att manipulera miljöförhållandena eller själva drogen, forskarna kanske kan kontrollera inte bara hastigheten på transporten utan också dess riktning – åtminstone i provrör i labbet. Att försöka bekräfta detta hos bakterier är ett av nästa steg i deras forskning, hon säger.
"Vi började med en mycket grundläggande vetenskaplig fråga om" hur fungerar dessa transportörer? och har snubblat över denna verkligen translationella riktning, " säger hon. "Människor har försökt rikta in sig på dessa typer av pumpar för att stoppa antibiotikaresistens för att göra antibiotika som vi redan har effektiva igen. Detta tyder på att du kanske inte bara kan stoppa det utan faktiskt använda dessa pumpar för att driva in läkemedel i cellen som en ny mekanism för inträngning av läkemedel."
Denna speciella transportör finns i många bakterier. Förvånande, forskare vet ännu inte dess verkliga funktion i cellen. Även om det pumpar ut antibiotika, det är inte huvudtransportören som hjälper E. coli i antibiotikaresistens, och det är möjligt att det har andra syften som fortfarande är oupptäckta. De har bara funnit att transporterar ett stort antal molekyler från färgämnen till antibiotika.
"Bakterier är konstant i krig med varandra, så kanske det spelar en roll för läkemedelsresistens, "Säger Henzler-Wildman." Men det kan också transportera något annat som vi inte har testat, eller kanske det fungerar i pH-resistens. Vi har inte begränsat det ännu."
Traditionellt, modellen som användes för att beskriva denna transportör var "ren utbytesmodell, "som krävde den strikta, regimenterad rörelse av protoner och läkemedlet i motsatta riktningar. Dock, verkligheten i denna process följer mantrat om "livet är rörigt."
Henzler-Wildman föreslår en ny modell som kallas "free-exchange model, " där kombinationerna och transportriktningen är mycket mer flexibla med många fler alternativ än man tidigare trott. De använde magnetisk resonansdata för att visualisera dessa specifika och tidigare okända rörelser hos transportören. Sedan studerade de hur exakt transportören reagerar i provröret när , till exempel, den är utsatt för antibiotika, för att bekräfta att det fungerar som strukturerna visade.
"Att behöva omarbeta modellen och i huvudsak skriva om läroboken om vad vi visste om transportörerna kommer verkligen att förändra vårt sätt att tänka, " säger hon. "Jag kommer faktiskt att undervisa om den här uppsatsen i vår introduktionskurs eftersom det är en så bra berättelse om hur att ha en modell i huvudet kan begränsa ditt tänkande och experiment och du verkligen missar viktiga saker."