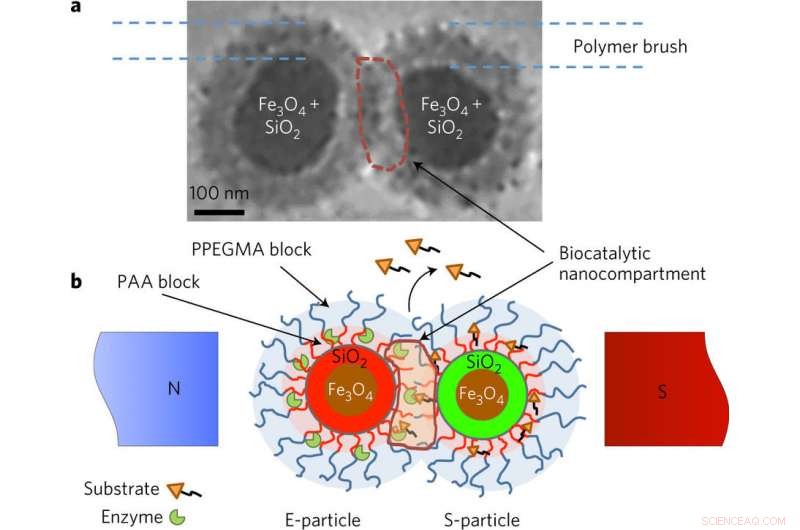
Superparamagnetiska nanopartiklar av E- och S-typ som bär enzymet och substratet. a, b, Kryotransmissionselektronmikroskopi (cryo-TEM) bild (a) och schematisk (b) som förklarar konceptet med magnetfältutlöst biokatalys. Den superparamagnetiska partikelkärnan är gjord av Fe3O4-nanopartiklar omslutna av kiseldioxid. Silikahöljet är märkt med kovalent bundna fluorescerande färgämnen (röd för E-partiklar och grön för S-partiklar). I magnetfältet, på grund av interaktioner mellan dipol och dipol, partiklarna kommer i kontakt, så att de borstliknande skalen med dubbla lager smälter samman och flätas samman, möjliggör interaktioner mellan enzymet och substratet. De inre skikten av borstskalet är gjorda av polyakrylsyra (PAA), som bär konjugerade molekyler av enzymer och substrat och tillhandahåller den sura miljön för hydrolytiska reaktioner. Det yttre skalet av poly(etylenglykol-metyleterakrylat)-polymer (PPEGMA) säkerställer en barriärfunktion för att blockera "obehöriga" eller för tidiga reaktioner av enzymet och substratet. Den biokatalytiska reaktionen är lokaliserad i den biokatalytiska nanoavdelningen, som genereras i magnetfältet. Reaktionen övervakas genom att detektera de frigjorda lastmolekylerna. Kredit:(c) Naturkatalys (2017). DOI:10.1038/s41929-017-0003-3
(Phys.org)—Ett team av forskare vid University of Georgia i Aten har utvecklat en teknik för att kontrollera kemiska reaktioner som frigör läkemedel inuti kroppen. I deras papper publicerad i tidskriften Naturkatalys , gruppen beskriver beläggningskemikalier för att förhindra att en reaktion inträffar tills appliceringen av ett magnetfält som frisätter ett önskat läkemedel.
I vissa medicinska tillämpningar, det är bättre för en medicinsk behandling om en kemikalie kan appliceras direkt på en viss del av kroppen och ingen annanstans. Kemikalier avsedda att behandla tumörer är det främsta exemplet - kemoterapiläkemedel verkar på varje cell de kontaktar, orsakar en mängd negativa biverkningar. I denna nya ansträngning, gruppen tog ett nytt tillvägagångssätt för att lösa detta problem, använda en magnet för att tvinga samman belagda kemikalier, orsakar en läkemedelsfrisättande reaktion.
För att tillhandahålla ett sätt att kontrollera när kemikalier kommer i kontakt inuti kroppen, forskarna skapade små paket genom att först belägga järnoxidnanopartiklar med kiseldioxid och sedan belägga dem ytterligare med två typer av polymerer, som, när de kombineras, bildar en borstliknande struktur. Vart och ett av paketen laddades sedan med antingen ett enzym eller ett substrat avsett att reagera med enzymet, och, självklart, läkemedlet som ska frigöras.
I praktiken, paketen skulle släppas in i kroppen på en patient, där de skulle ta sig till hela kroppen, beter sig ofarligt, eftersom borstarna hindrar dem från att reagera när de möts. När paketen tog sig till en plats där en reaktion önskades, forskaren applicerade en magnet som tvingade dem nära varandra – tillräckligt nära för att de kunde reagera, släpper ut drogen. De andra paketen som inte är inblandade i reaktionen skulle sakta spolas ut ur kroppen naturligt, utan att orsaka skada.
Forskarna testade sina paket in vitro med ett riktigt kemoterapiläkemedel och cancerceller. De rapporterar att det fungerade precis som de hade tänkt sig. Fler tester krävs, självklart, för att säkerställa att tekniken är säker, men om allt går bra, det kan så småningom användas för att behandla en mängd olika cancerformer.
© 2017 Phys.org