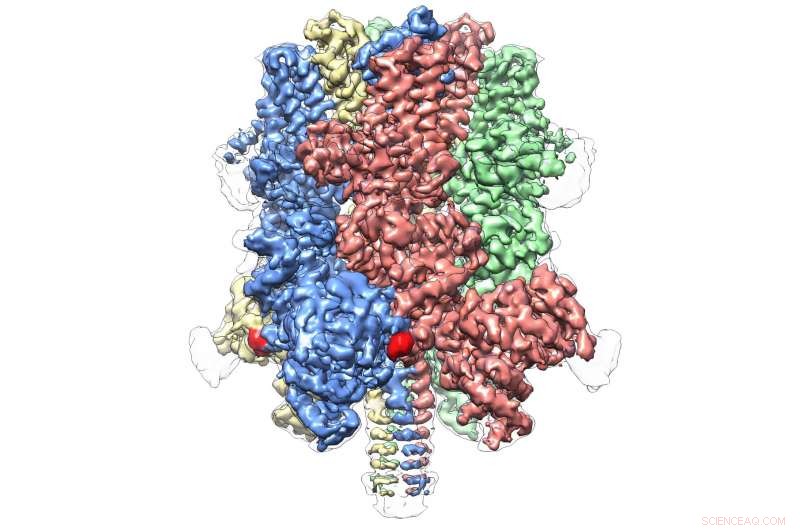
Human TRPM4 bunden med agonisten Ca+ och modulator DVT vid 3,8 Å. Upphovsman:Wei Lü, Ph.D.
Ett team som leds av forskare vid Van Andel Research Institute (VARI) har för första gången avslöjat strukturen på atomnivå för ett lovande läkemedelsmål för tillstånd som stroke och traumatisk hjärnskada.
Kallas TRPM4, detta protein finns i vävnader i hela kroppen, inklusive hjärnan, hjärta, njure, tjocktarm och tarmar, där det spelar en viktig roll för att reglera blodflödet via blodkärlsförträngning samt att ställa in hjärtrytmen och dämpa immunsvaret.
"Att förstå vilken roll TRPM4 spelar för att reglera cirkulationen är avgörande, men i åratal har forskning begränsats av brist på insikt om dess molekylära arkitektur, "sa Wei Lü, Ph.D., en biträdande professor vid VARI och huvudförfattare till en studie som beskriver TRPM4:s struktur, publicerad idag i Natur . "Våra resultat ger inte bara en detaljerad, karta på atomnivå över detta kritiska protein, men avslöjar också helt oväntade aspekter av dess smink. "
TRPM4 är kritiskt involverad i reglering av blodtillförseln till hjärnan, som endast omfattar cirka 2 procent av kroppens totala vikt men ändå får 15 till 20 procent av dess blodtillförsel. Tillstånd som stör blodflödet i hjärnan, som stroke, traumatisk hjärnskada, cerebralt ödem och hypertoni, kan få förödande konsekvenser och är betydande folkhälsoproblem.
"Många skyddsåtgärder finns i hjärnans cirkulationssystem för att skydda mot ett plötsligt avbrott i blodtillförseln, varav en är TRPM4, "Lü sa." Vi hoppas att en bättre förståelse för hur detta protein ser ut kommer att ge forskare en molekylär ritning som bygger på utformningen av mer effektiva mediciner med färre biverkningar. "
Strukturen för TRPM4 skiljer sig markant från de andra molekylerna i TRP -superfamiljen, en kategori proteiner som förmedlar svar på förnimmelser och sensoriska stimuli, som smärta, tryck, syn, temperatur och smak. Allmänt känt som jonkanaler, proteiner som TRP ligger inuti cellens membran, fungerar som portvakter för kemiska signaler som passerar in och ut ur cellen.
Även inom sin egen underfamilj, som omfattar totalt åtta molekyler, TRPM4 verkar vara helt unik. Dagens publikation representerar den första atombilden av en medlem i TRPM -underfamiljen.
Det avslöjar en kronliknande struktur, med de fyra topparna som utgör en stor N-terminal domän-ett kännetecken för TRPM-proteiner. Denna region, hittades i början av molekylen, är en viktig plats för interaktion med cellmiljön och andra molekyler i kroppen. I motsatt ände av TRPM4, vanligen kallad C-terminal domän, Lüs team hittade en paraplyliknande struktur som stöds av en "pol" och fyra spiralformade "revben"-egenskaper som aldrig tidigare har observerats.
Resultaten möjliggjordes av VARI:s toppmoderna David Van Andel Advanced Cryo-Electron Microscopy Suite, som gör det möjligt för forskare att se några av livets minsta komponenter i utsökt detalj. VARI:s största mikroskop, Titan Krios, är en av färre än 120 i världen och är så kraftfull att den kan visualisera molekyler 1/10, 000:e bredden på ett människohår.
Lüs struktur är den andra molekylstrukturen som bestäms på institutets Krios sedan installationen av sviten tidigare i år.