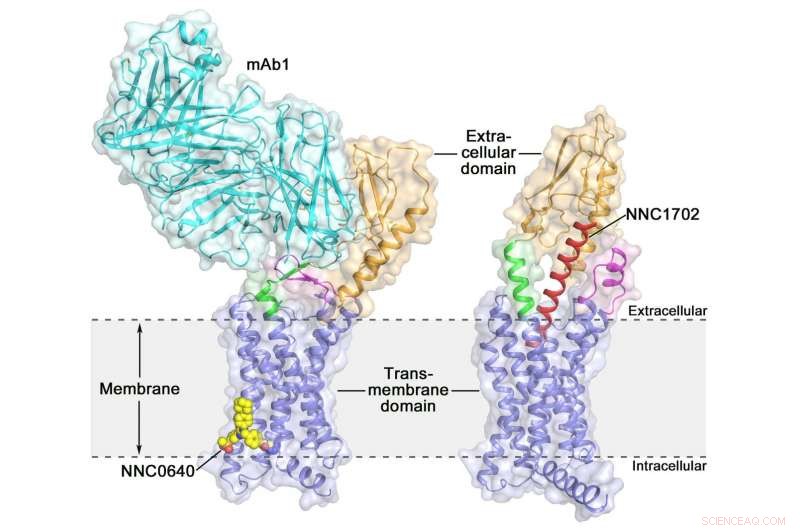
Kristallstrukturen för kristallstrukturen i full längd för mänsklig glukagonreceptor (GCGR) för den humana glukagonreceptorn (GCGR) i full längd:orange (extracellulär domän), blå (transmembrandomän), grön (stjälk), magenta (den första extracellulära öglan), röd (NNC1702), gul (NNC0640) och cyan (mAb1) Kredit:Dr. WU Beili
Klass B G proteinkopplade receptorer (GPCR) utövar väsentlig verkan vid hormonell homeostas och är viktiga terapeutiska mål för en mängd olika sjukdomar inklusive metaboliska störningar som typ 2-diabetes. Dessa receptorer består av en extracellulär domän (ECD) och en transmembrandomän (TMD), som båda krävs för att interagera med sina närstående peptidligander och för att reglera nedströms signaltransduktion. På grund av svårigheter med högkvalitativt proteinberedning, fastställandet av strukturen för GPCR i full längd är fortfarande en utmaning, vilket begränsar förståelsen av molekylära mekanismer för receptorverkan.
Aktivering av den humana glukagonreceptorn (GCGR) med dess endogena ligandglykagon utlöser frisättning av glukos från levern under fastan, vilket gör det till ett potentiellt läkemedelsmål för typ 2 -diabetes. Förra året, en grupp forskare vid Shanghai Institute of Materia Medica (SIMM) från den kinesiska vetenskapsakademin bestämde kristallstrukturen för GCGR i full längd bunden till en negativ allosterisk modulator NNC0640 och en hämmande antikropp mAb1, ger därmed för första gången en tydlig bild av en GPCR i full längd med hög upplösning.
Nyligen, forskare vid SIMM bestämde kristallstrukturen för GCGR i komplex med en glukagonanalog och partiell agonist NNC1702. Denna struktur avslöjar, för första gången, de molekylära detaljerna för en klass B GPCR -bindning till dess peptidligand vid hög upplösning och avslöjar oväntat den strukturella komplexitet som styr receptoraktivering, därigenom kraftigt utöka förståelsen för klass B GPCR -signaltransduktion. Studien publicerades i Natur .
Denna studie ger några värdefulla insikter om aktiveringsmekanismen för GCGR. Det mest spännande fyndet är att länkaregionen som förbinder ECD och TMD i receptorn, kallade "stjälken, "och den första extracellulära slingan genomgår betydande konformationsförändringar i deras sekundära strukturer i den peptidbundna GCGR-strukturen jämfört med den tidigare bestämda icke-peptidbundna strukturen. Detta leder till en markant förändring i den relativa orienteringen mellan ECD och TMD hos receptor för att rymma peptidbindning och initiera receptoraktivering.
Vidare, stjälken kan modulera receptoraktivitet genom att underlätta konformationsrörelser hos receptorn TMD. "Det är fantastiskt att observera hur stjälkregionen spelar en så viktig roll för att reglera receptorfunktionen, även om den bara innehåller 12 aminosyror, "sa SIMM -professor Dr ZHAO Qiang." Detta har aldrig observerats i tidigare lösta GPCR -strukturstudier. Det fördjupar betydligt kunskapen om klass B GPCR -signalmekanismer. "
Baserat på strukturen för GCGR-NNC1702-komplexet, forskarna utförde en serie funktionella studier med hjälp av tekniker som tävlingsligandbindning, cellsignalering, molekylära dynamiksimuleringar och dubbel elektron-elektronresonansspektroskopi. Resultaten stöder GCGR -strukturen och bekräftar konformationsförändringarna av receptorn i olika funktionella tillstånd.
"Den nyligen lösta GCGR -strukturen ger den mest exakta mallen hittills för läkemedelsdesign riktad mot GCGR, som erbjuder nya möjligheter inom läkemedelsupptäckt för behandling av typ 2 -diabetes, "sade teamledare och SIMM -professor Dr WU Beili.