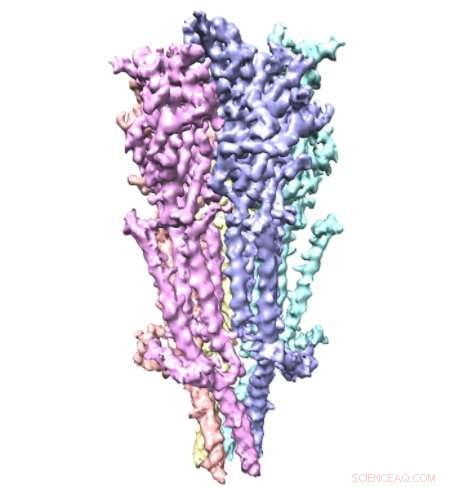
Kredit:Case Western Reserve University
Ett team av forskare från Case Western Reserve University School of Medicine har använt Nobelprisbelönt mikroskopteknologi för att se fullängds serotoninreceptorer för första gången. De små proteinerna – ungefär en miljarddels meter långa – är vanliga läkemedelsmål, trots begränsad tillgänglig information om deras struktur. Nu, nya bilder publicerade i Naturkommunikation tillhandahålla ögonblicksbilder av receptorerna, inklusive detaljer om molekylära bindningsställen som kan leda till mer exakt läkemedelsdesign.
Serotoninreceptorer sitter i cellmembran i hela kroppen, inklusive hjärnan, mage, och nerver. De är mycket dynamiska med många rörliga delar, gör dem svåra att fånga. Forskare bryter vanligtvis receptorn i bitar för att studera den. Men genom att studera fullängds serotoninreceptorer, forskare i den nya studien visade hur dess olika delar interagerar. Forskarna beskriver "en finstämd orkestrering av tre domänrörelser" som tillåter receptorerna att elegant kontrollera passager över cellmembran.
Studien avslöjar hur serotoninreceptorer fungerar, säger studiens första författare Sandip Basak, PhD, postdoktor vid avdelningen för fysiologi och biofysik vid Case Western Reserve University School of Medicine. "Serotoninreceptorn fungerar som en inkörsport, eller kanal, från utanför cellen till insidan, " säger han. "När serotonin binder till receptorn, kanalen växlar konformation från stängd till öppen. Det förvandlas så småningom till ett "desensibiliserat" tillstånd, där kanalen stängs men serotonin förblir fäst. Detta förhindrar att det återaktiveras." Olika konformationer hjälper serotoninreceptorer att fungera som "gatekeepers" i cellmembran.
Läkemedel som fäster vid serotoninreceptorer och hämmar dem - även kallade Setrons - ordineras allmänt för att kontrollera kräkningar i samband med cancerterapier och gastrointestinala sjukdomar. Men många av dessa läkemedel kommer med allvarliga biverkningar. "Många människor som tar dessa läkemedel upplever obehagliga symtom. Dessa biverkningar har förhindrat mer utbredd användning, " säger studieledaren Sudha Chakrapani, PhD, docent i fysiologi och biofysik vid Case Western Reserve University School of Medicine. Hon föreslår att design av läkemedel som riktar sig mot specifik konformation av serotoninreceptorer kan hjälpa.
"Framgångsrik design av säkrare terapier har saktat ner eftersom det för närvarande finns en begränsad förståelse för strukturen av serotoninreceptorn i sig, och vad som händer efter att serotonin binder, "Säger Chakrapani. "Vår nya struktur av serotoninreceptorn i vilotillstånd har potential att fungera som en strukturell plan för att driva riktad läkemedelsdesign och bättre terapeutiska strategier."
Den nyligen avslöjade strukturen sätter scenen för att bestämma strukturer för receptorn i de aktiva och läkemedelsbundna formerna. Dessa upptäckter är avgörande för att måla upp en helhetsbild av hur receptorn fungerar. Forskare kunde tillämpa samma teknik som användes i den nya studien - kryoelektronmikroskopi - för att avslöja ytterligare serotoninreceptorkonformationer. Tekniken fick ett Nobelpris 2017 och har redan hjälpt forskare att lösa 3D-strukturer för proteiner som är centrala för njursten och andra åkommor. "Cryo-EM" gör det möjligt för forskare att zooma in och se proteinstrukturer i atomär detalj. De kraftfulla mikroskopen tar ögonblicksbilder av proteiner i aktion, och kompilera dem till 3D-strukturmodeller.