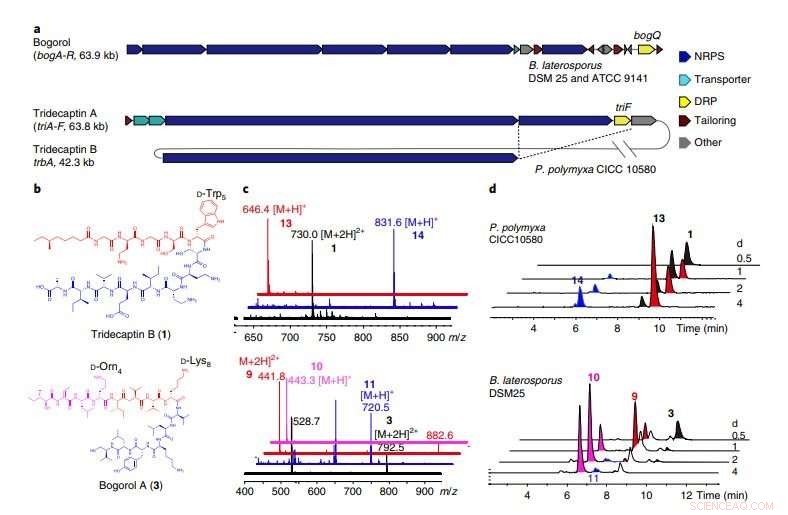
a, BGC för bogorol från B. laterosporus DSM 25 och ATCC 9141, såväl som tridecaptin A och tridecaptin B från P. polymyxa CICC 10580. BogQ från stammen DSM 25 och den från stammen ATCC 9141 delar 85 procent aminosyrasekvensidentitet. De skärande prickade linjerna indikerar gener som delas av två genkluster inom samma värd (kompletterande fig. 10). b, Strukturer av DNRP tridecaptin B och bogorol A, med DRP-igenkänningsmotiv markerade. c, Staplad överlagring av masspektra (elektrosprayjonisering) av moderföreningar (svart), C-terminala fragment (blå), och N-terminala fragment (röda). Data är representativa för två oberoende experiment. Topp, tridekaptin B; botten, bogorol A. d, Tidsförloppsanalyser av motsvarande föreningar producerade av P. polymyxa CICC 10580 (överst) och B. laterosporus DSM 25 (nederst) vid olika jäsningstider (representativa för tre oberoende experiment). Kredit:Division of Life Science, HKUST
Icke-ribosomala peptidantibiotika, inklusive polymyxin, vankomycin, och teixobactin, de flesta innehåller D-aminosyror, är mycket effektiva mot multiresistenta bakterier. Dock, överanvändning av antibiotika samtidigt som man ignorerar risken för att resistens uppstår har obönhörligen lett till en omfattande uppkomst av resistenta bakterier. Att klargöra de föga kända mekanismerna för resistens mot peptidantibiotika är avgörande vid implementering av peptidantibiotika och skulle effektivt förbättra effektiviteten.
I en nyligen genomförd studie, en grupp forskare från Hong Kong University of Science and Technology avslöjar både den utbredda distributionen och bredspektrumresistenspotentialen hos D-stereospecifika peptidaser, tillhandahåller en potentiell tidig indikator på antibiotikaresistens mot icke-ribosomala peptidantibiotika.
Deras resultat publicerades i tidskriften Naturens kemiska biologi den 26 februari, 2018.
"Vi tillämpade en metod för 5, 585 kompletta bakteriegenom som spänner över hela bakteriedomänen, " sa Pei-Yuan Qian, ordförande professor vid avdelningen för livsvetenskap, HKUST, och huvudförfattare till tidningen. "Med efterföljande kemiska och enzymatiska analyser, vi visade en mekanism för resistens mot icke-ribosomala peptidantibiotika som är baserad på hydrolytisk klyvning av D-stereospecifika peptidaser."
Teamet identifierade en familj av D-stereospecifika resistenspeptidaser (DRP) som är fylogenetiskt brett spridda i naturen. De upptäckta DRP:er visade sig vara inblandade i att bekämpa vitt spridda antibiotika innehållande D-aa för att överleva deras värd, som experimentellt validerades av en kombination av CRISPR/Cas9-baserad genredigering, kemiska och enzymatiska analyser.
"Med tanke på potentialen hos DRP för bredspektrumresistens och deras potential att rikta in sig på kliniskt viktiga antibiotika som innehåller D-aa, dessa brett spridda resistensgener är sannolikt särskilt farliga om de överförs till opportunistiska patogener, ", sa Prof. Qian. "Fynden av DRP i naturen utgör bara toppen av isberget, vilket kommer att leda till intensiv forskning om användning och utveckling av peptidantibiotika för att bekämpa antibiotikaresistens."
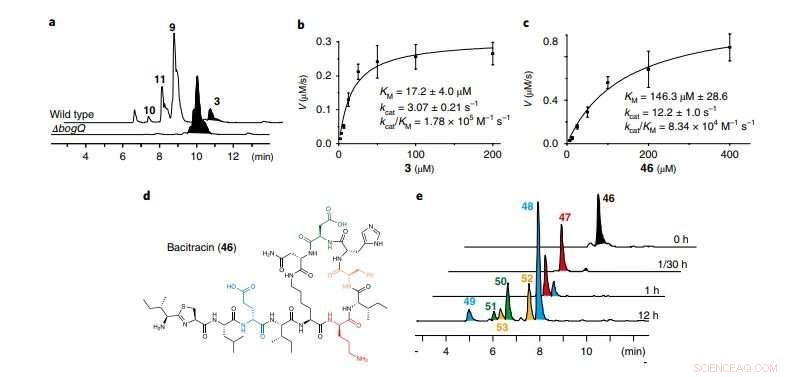
a, LC-MS-spår som jämför vildtyp B. laterosporus ATCC 9141 och ΔbogQ-mutanten (representativ för tre oberoende experiment). b, c, Kinetiska analyser av BogQ-katalyserad hydrolys av bogorol A (b; 3) och bacitracin (c; 46) v, reaktionshastighet. Data är medelvärde?±?s.d.; n=?3 oberoende experiment. d, Struktur av DNRP-antibiotikumet bacitracin; färger framhäver klyvningsställena för BogQ. e, LC-MS spår av in vitro-analyser av BogQ (2,0 μM) mot 46 (200 μM; representativt för två oberoende experiment). Tidsförloppsklyvningsprodukter (47-53) av 46 är märkta med samma färgkod som deras d-aa-klyvningsställen i d. För enzymatiska klyvningsmönster, se tilläggsbild 22. Kredit:Division of Life Science, HKUST