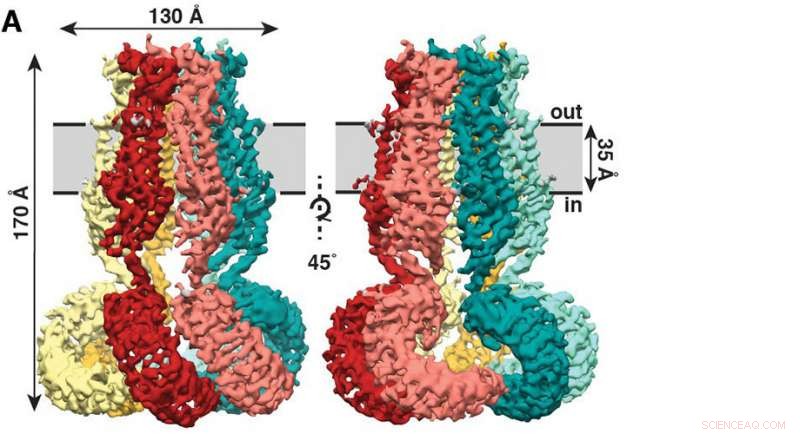
Den nya studien, publicerades nyligen i tidskriften eLife , visar att SWELL1 är gjord av sex underenheter som möts på toppen, buntas ihop till en manetliknande mantel med sex rankor som hänger ner. Kredit:Kefauver et al, Scripps Research
Forskare vid Scripps Research har löst strukturen hos ett nyckelprotein som känner av när våra celler sväller. Detta protein, kallas SWELL1 (eller LRRC8A), fungerar som en "jonkanal" på cellmembranet för att avlasta trycket inuti cellerna.
Den nya studien, publicerades nyligen i tidskriften eLife , visar att SWELL1 är gjord av sex underenheter som möts på toppen, buntas ihop till en manetliknande mantel med sex rankor som hänger ner.
"Denna struktur ger en första inblick i hur den här jonkanalen känner av volymförändringar i en cell, " säger Jennifer Kefauver, doktorand vid Scripps Research, Howard Hughes Medical Institute, och första författare till den nya studien.
SWELL1 upptäcktes 2014 i labbet av Ardem Patapoutian, Ph.D., professor vid Scripps Research och utredare vid Howard Hughes Medical Institute. Upptäckten öppnade dörren till avgörande studier om hur proteinet fungerar.
Nästa viktiga steg var att belysa SWELL1:s molekylära struktur. Forskarna syftade till att förstå grunderna för hur denna jonkanal känner av förändringar i volym. Att göra detta, de behövde ta en titt på kanalens molekylära maskineri.
Kefauver ledde studierna som en gemensam student mellan Patapoutians och Andrew Wards labb, Ph.D., professor vid Scripps Research och ledare inom en högupplöst bildteknik som kallas kryo-elektronmikroskopi (cryo-EM). Kefauver använde cryo-EM-tekniker för att lösa SWELL1s manetliknande struktur och få en första titt på hur joner kan färdas genom kanalens centrala por. "Jennifer följde strukturen av SWELL1 med stor envishet, lämnar ingen sten ovänd och övervinner otaliga hinder. Det var underbart att se frukterna av hennes arbete resultera i en så vacker struktur, sa Ward.
Denna nya titt på jonkanalen tyder på att interagerande delar av rankorna-platser som har en positiv eller en negativ laddning känner av en förändring i jonstyrka i cellen (en utspädning av cellens saltinnehåll när den absorberar vatten). De laddade resterna kan skicka en signal upp till kanalens por, säger till kanalen att frigöra kloridjoner från cellen och lätta på trycket.
Kefauver hoppas att denna nya syn på strukturen kan underblåsa medicinsk forskning. SWELL1 har en roll i minst en sjukdom - en immunbrist som kallas agammaglobulinemi. "Att ha strukturen är verkligen viktigt för forskare som försöker förstå hur den här kanalen fungerar och vad sjukdomsorsakande mutationer kan göra."
Nästa, forskarna tittade närmare på hur de olika delarna av SWELL1-strukturen påverkar kanalfunktionen. De fann att mutation av proteinet på någon av två platser hindrar strukturen från att korrekt kontrollera trafiken genom jonkanalen.
Den nya studien visar bara buntar av SWELL1-subenheten - och forskare vet att SWELL1 måste finnas där för en funktionell kanal. Men upp till fyra andra underenheter kan byta in i strukturen på olika platser. Kefauver säger att nästa steg är att bestämma hur olika kombinationer av SWELL1-subenheter möts för att bilda jonkanaler med olika aktiviteter.