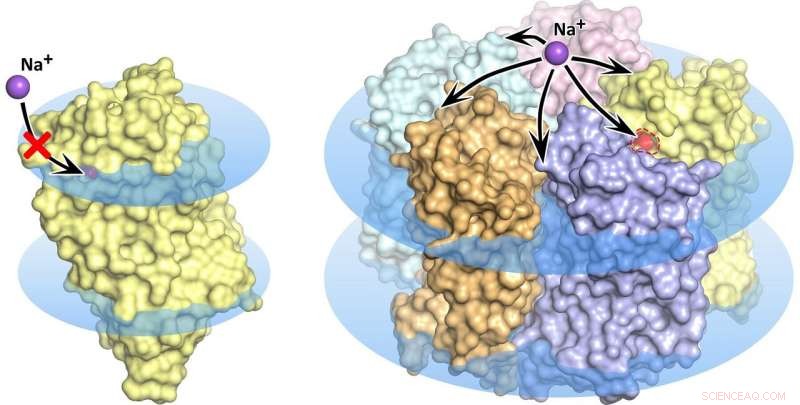
KR2 rhodopsin monomer (vänster) och pentamer (höger) i cellmembranet, visas som blå skivor. I monomertillståndet, natriumtransport är blockerad, den orangea poren tillåter inte jonupptag i proteinet. Kredit:Kirill Kovalev et al./ Vetenskapens framsteg
Ett team av biofysiker från Ryssland, Tyskland, och Frankrike, med forskare från Moskvas institut för fysik och teknik, har upptäckt och studerat strukturen av KR2 rhodopsin under fysiologiska förhållanden. Detta banbrytande arbete bryter mark för ett framtida genombrott inom optogenetik, ett mycket relevant område inom biomedicin med tillämpningar inom neurologisk sjukdomsbehandling med mera. Den grundläggande upptäckten kommer att leda till ett nytt instrument för effektiv terapi av depression, ångeststörningar, epilepsi, och Parkinsons sjukdom. Tidningen som rapporterade studien publicerades i Vetenskapens framsteg .
Optogenetik är ett helt nytt område inom biofysik och biomedicin som utforskar tekniker för att kontrollera nerv- och muskelcellerna i en levande organism via ljussignaler. Inte så länge sedan, den ledande forskningstidskriften Vetenskap hyllade optogenetik som "årtiondets genombrott". Optogenetiska metoder möjliggör redan en partiell återhämtning av förlorad syn, hörsel, och muskelkontroll försämrad av en neurologisk sjukdom. Viktigt, dessa tekniker tillåter forskare att studera neurala nätverk i detalj. Detta syftar inte på datornätverk utan till de som finns i den mänskliga hjärnan och ansvarar för våra känslor, beslutsfattande, och andra grundläggande processer.
Många år sedan, forskare upptäckte en ny typ av jontransportör - KR2 rhodopsin - i cellmembranet hos den marina bakterien Krokinobacter eikastus. Det nyfunna proteinet är känsligt för ljus, vilket gör det användbart för optogenetik. Drivs av ljus, sådana proteiner kan underlätta translokationen av laddade partiklar såsom joner över cellmembranet. Genom att införa sådana transportörer i cellen, forskare kan sedan använda ljuspulser för att manipulera potentialen hos neuroncellmembranet, kontrollera sin verksamhet. KR2 visades selektivt transportera en viss typ av partiklar - natriumjoner - utanför cellen. Istället för att tillåta passage av dessa joner i båda riktningarna, proteinet utför aktiv transport, fungerar som en "pump". Muterade former av KR2 visade också kaliumpumpande aktivitet. Genom att implantera dessa pumpar i cellmembranet, hela omfattningen av neuronaktivitet skulle teoretiskt kunna kontrolleras.
Vågen av forskning som följde upptäckten av den nya molekylära pumpen stod inför några ganska mystiska egenskaper hos rhodopsin. Flera forskargrupper upptäckte och beskrev totalt fem olika strukturer av det lovande proteinet. I synnerhet, i några av dessa strukturer bildar fem KR2-molekyler en stabil pentamer, medan i andra endast proteinmonomeren är närvarande (figur 1).
"Så den dramatiska frågan var:Vilken av dessa strukturer bör anses vara den rätta?" sa MIPT doktorand Kirill Kovalev, en huvudförfattare till studien. "Faktiskt, strukturerna visade sig vara ganska lika, men djävulen ligger i detaljerna, som bestämmer proteinets möjliga tillämpningar inom vetenskap och klinisk praxis."
Leds av MIPT biofysiker, teamet hittade vad som ger upphov till den förvirrande variationen av proteinstrukturer. Det visade sig att forskargrupperna som studerade KR2 hade kristalliserat proteinet vid olika förhållanden. Det unika proteinet produceras ursprungligen av en havsbakterie som är hemma i en mycket speciell miljö. Den lever i vatten med en specifik salthalt, aciditet, och vätejonkoncentration (pH). Dessa förhållanden är en förutsättning för att proteinet ska göra vad forskarna förväntar sig att det ska göra – det vill säga pumpa natriumjoner, samtidigt som det bildar pentamerer i cellmembranet. Proteinets många "falska" strukturer visade sig antingen vara kristallisationsartefakter eller bara motsvara de förhållanden som praktiskt taget inaktiverar den natriumpumpande aktiviteten hos KR2, vilket gör det mycket attraktivt för den globala optogenetikgemenskapen.
"För första gången, vi har simulerat de fysiologiska förutsättningarna för KR2:s existens och funktion. Som ett resultat, vi fick den "korrekta" strukturen för det nya proteinet, som motsvarar dess inhemska tillstånd. Vi visade att proteinets funktionella enhet är en pentamer, " förklarade Valentin Gordeliyf från Institute of Structural Biology i Grenoble. "Utöver det, vi hittade en förklaring till motsättningarna mellan tidigare strukturella studier av proteinet."
KR2 rhodopsin är revolutionerande för optogenetik, och att känna till dess korrekta struktur under fysiologiska förhållanden är grundläggande både för att förstå mekanismerna bakom dess funktion och för att utforska nervsystemet genom att modellera nya optogenetiska verktyg och tillämpa dem i den medicinska praktiken.