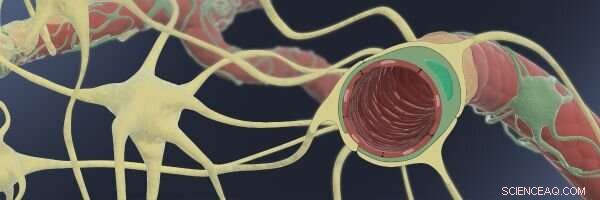
Den här illustrationen visar hur In the Blood-Brain-Barrier (BBB), tunna endotelkapillärer (röda) lindas av stödjande pericyter (gröna) och astrocyter (gula), gör det möjligt för dem att generera en tät barriär med mycket selektiva transportfunktioner för molekyler som kommer in i hjärnvätskan från blodomloppet. Kredit:Wyss Institute vid Harvard University
Liksom säkerhetshinder för flygplatser som antingen rensar auktoriserade resenärer eller blockerar obehöriga resenärer och deras bagage från att komma åt centrala operationsområden, blod-hjärnbarriären (BBB) kontrollerar noggrant transporten av viktiga näringsämnen och energimetaboliter in i hjärnan och hindrar oönskade ämnen som cirkulerar i blodomloppet. Viktigt, Dess välorganiserade struktur av tunna blodkärl och stödjande celler är också det största hindret som hindrar livräddande läkemedel från att nå hjärnan för att effektivt behandla cancer, neurodegeneration, och andra sjukdomar i centrala nervsystemet. I ett antal hjärnsjukdomar, BBB kan också bryta ner lokalt, orsakar neurotoxiska ämnen, blodkroppar och patogener att läcka in i hjärnan och orsaka irreparabel förödelse.
För att studera BBB och drogtransport över den, forskare har mestadels förlitat sig på djurmodeller som möss. Dock, de exakta sammansättnings- och transportfunktionerna hos BBBs i dessa modeller kan skilja sig avsevärt från dem hos mänskliga patienter, vilket gör dem opålitliga för att förutsäga läkemedelsleverans och terapeutisk effektivitet. Även in vitro-modeller som försöker återskapa den mänskliga BBB med hjälp av primära hjärnvävnadshärledda celler har hittills inte kunnat efterlikna BBB:s fysiska barriär, transportfunktioner, och läkemedels- och antikroppstransportaktiviteter tillräckligt nära för att vara användbara som terapeutiska utvecklingsverktyg.
Nu, ett team ledd av Donald Ingber, M.D., Ph.D. vid Harvards Wyss Institute for Biologically Inspired Engineering har övervunnit dessa begränsningar genom att utnyttja sin mikrofluidiska Organs-on-Chips (Organ Chips)-teknologi i kombination med ett utvecklingsinspirerat hypoxi-härmande tillvägagångssätt för att differentiera mänskliga pluripotenta stamceller (iPS) till hjärnans mikrovaskulära endotelial. celler (BMVEC). Det resulterande "hypoxiförstärkta BBB-chipet" rekapitulerar cellulär organisation, snäva barriärfunktioner och transportförmågor hos den mänskliga BBB; och det tillåter transport av läkemedel och terapeutiska antikroppar på ett sätt som mer efterliknar transport över BBB in vivo än existerande in vitro-system. Deras studie redovisas i Naturkommunikation .
"Vårt tillvägagångssätt för att modellera läkemedel och antikroppar som skjuts över den mänskliga BBB in vitro med så hög och aldrig tidigare skådad trohet presenterar ett betydande framsteg jämfört med befintliga möjligheter inom detta enormt utmanande forskningsområde, ", sa Wyss Institutes grundare Ingber. "Det löser ett kritiskt behov i läkemedelsutvecklingsprogram i hela läkemedels- och bioteknikvärlden som vi nu vill hjälpa till att övervinna med ett dedikerat 'Blood-Brain Barrier Transport Program' vid Wyss Institute med vår unika talang. och resurser. "Ingber är också Judah Folkman professor i vaskulär biologi vid HMS och Vascular Biology Program på Boston Children's Hospital, samt professor i bioteknik vid SEAS.
BBB består av tunna kapillärblodkärl som bildas av BMVEC, multifunktionella celler kända som pericyter som sveper sig runt utsidan av kärlen, och stjärnformade astrocyter, som är icke-neuronala hjärnceller som också kommer i kontakt med blodkärl med fotliknande processer. I närvaro av pericyter och astrocyter, endotelceller kan generera den tätt förslutna kärlväggsbarriären som är typisk för den mänskliga BBB.
Ingbers team differentierade först mänskliga iPS-celler till hjärnens endotelceller i odlingsskålen med en metod som tidigare hade utvecklats av medförfattaren Eric Shusta, Ph.D., Professor i kemi- och biologisk teknik vid University of Wisconsin-Madison, men med den extra kraften av bioinspiration. "För att i embryot, BBB bildas under förhållanden med låg syrehalt (hypoxi), vi differentierade iPS -celler under en längre tid i en atmosfär med bara 5% istället för den normala syrekoncentrationen på 20%, "sa den första författaren Tae-Eun Park, Ph.D. "Som ett resultat, iPS-cellerna initierade ett utvecklingsprogram mycket likt det i embryot, producerar BMVEC som uppvisade högre funktionalitet än BMVEC som genererades under normala syreförhållanden." Park var postdoktor i Ingbers team och är nu biträdande professor vid Ulsan National Institute of Science and Technology i Republiken Korea.

I det förbättrade mänskliga BBB-chipet, endotelceller härledda från inducerade mänskliga pluripotenta stamceller i en utvecklingsinspirerad process, bildar ett mikrokärl i den nedre av två parallella mikrofluidkanaler (nedre bilder), medan pericyter och astrocyter som befolkar den övre kanalen ansluter till mikrokärlet över ett delande poröst membran. Kredit:Wyss Institute vid Harvard University
Bygger på en tidigare mänsklig BBB-modell, forskarna överförde sedan de hypoxiinducerade humana BMVEC:erna till en av två parallella kanaler i en mikrofluidisk Organ-on-Chip-enhet som delas av ett poröst membran och kontinuerligt perfunderas med medium. Den andra kanalen var befolkad med en blandning av primära mänskliga hjärnans pericyter och astrocyter. Efter ytterligare en dag med hypoxibehandling, det mänskliga BBB-chippet kunde bibehållas stabilt i minst 14 dagar vid normala syrekoncentrationer, vilket är mycket längre än tidigare in vitro humana BBB-modeller som försökts tidigare.
Under vätskans skjuvspänning som perfunderar BBB -chipet, BMVEC fortsätter att bilda ett blodkärl, och utveckla en tät gränsyta med pericyter i linje med dem på andra sidan av det porösa membranet, såväl som med astrocyter som förlänger processer mot dem genom små öppningar i membranet. "Den distinkta morfologin hos den konstruerade BBB är parallell med bildandet av en tätare barriär som innehåller förhöjda antal selektiva transport- och läkemedelstransportsystem jämfört med kontroll-BBS som vi genererade utan hypoxi eller vätskeskjuvspänning, eller med endotel som härrör från vuxen hjärna istället för iPS-celler, sa Nur Mustafaoglu, Ph.D., en medförsta författare på studien och postdoktor som arbetar med Ingbers team. "Dessutom, vi skulle kunna efterlikna effekterna av behandlingsstrategier hos patienter på kliniken. Till exempel, vi öppnade BBB reversibelt under en kort tid genom att öka koncentrationen av ett mannitollöst ämne [osmolaritet] för att möjliggöra passage av stora läkemedel som anticancerantikroppen Cetuximab. "
För att ge ytterligare bevis på att det hypoxiförstärkta mänskliga BBB-chipet kan användas som ett effektivt verktyg för att studera läkemedelsleverans till hjärnan, laget undersökte en rad transportmekanismer som antingen hindrar läkemedel från att nå sina mål i hjärnan genom att pumpa tillbaka dem i blodströmmen (utflöde), eller det, i kontrast, tillåta selektiv transport av näringsämnen och läkemedel över BBB (transcytos).
"När vi specifikt blockerade funktionen hos P-gp, en viktig endotelial effluxpump, vi skulle kunna avsevärt öka transporten av anticancerläkemedlet doxorubicin från kärlkanalen till hjärnkanalen, mycket likt det som har observerats hos mänskliga patienter, sade Park. vårt in vitro-system skulle kunna användas för att identifiera nya tillvägagångssätt för att minska utflödet och därmed underlätta transport av läkemedel in i hjärnan i framtiden."
På en annan plats, läkemedelsutvecklare försöker utnyttja "receptormedierad transcytos" som ett verktyg för transport av läkemedelsladdade nanopartiklar, större kemiska och proteinläkemedel, såväl som terapeutiska antikroppar över BBB. "Det hypoxiförstärkta mänskliga BBB-chipet rekapitulerar funktionen hos kritiska transcytosvägar, såsom de som används av LRP-1 och transferrinreceptorer som är ansvariga för att ta upp vitala lipoproteiner och järn från cirkulerande blod och släppa ut dem i hjärnan på andra sidan av BBB. Genom att utnyttja dessa receptorer med olika prekliniska strategier, vi kan troget härma den tidigare påvisade shuttlingen av terapeutiska antikroppar som riktar sig mot transferrinreceptorer in vivo, samtidigt som BBB:s integritet bibehålls in vitro, sa Mustafaoglu.
Baserat på dessa fynd, Wyss Institute har initierat ett "Blood-Brain Barrier Transport Program". "Initialt, BBB Transport Program syftar till att upptäcka nya skyttelmål som är berikade på BMVEC:s vaskulära yta, med hjälp av ny transkriptomik, proteomik, och iPS-cell närmar sig. Parallellt, vi utvecklar helt mänskliga antikroppsskyttlar riktade mot kända skyttelmål med förbättrad hjärninriktning, sa James Gorman, M.D., Ph.D., personalledaren för BBB Transport Program som arbetar med Ingber. "Vi strävar efter att samarbeta med flera biofarmaceutiska partners i ett pre-konkurrensförhållande för att utveckla skyttlar som erbjuder exceptionell effektivitet och teknisk flexibilitet för inkorporering i antikropps- och proteinläkemedel, eftersom detta är så välbehövligt av patienter och hela fältet”.
Författarna tror att förutom studier av läkemedelsutveckling, det hypoxiförstärkta mänskliga BBB-chipet kan också användas för att modellera aspekter av hjärnsjukdomar som påverkar BBB, såsom Alzheimers och Parkinsons sjukdom, och till avancerade personliga medicinska tillvägagångssätt genom att använda patienthärledda iPS-celler.