
MIT biträdande professor Betar Gallant (till vänster) och doktorand Aliza Khurram utvecklar ett nytt batteri som både kan fånga upp koldioxid i kraftverkens avgaser och omvandla det till ett fast material som är redo för säker kassering. Kredit:Stuart Darsch
Minska koldioxid (CO 2 ) utsläpp från kraftverk anses allmänt vara en viktig komponent i alla planer för begränsning av klimatförändringar. Många forskningsinsatser fokuserar på att utveckla och distribuera system för avskiljning och lagring av koldioxid (CCS) för att behålla CO 2 utsläpp från kraftverk ur atmosfären. Men att separera den fångade CO 2 och omvandla den till en gas som kan lagras kan förbruka upp till 25 procent av en anläggnings kraftproduktionskapacitet. Dessutom, kompaniet 2 gas injiceras i allmänhet i underjordiska geologiska formationer för långtidslagring - en deponeringsmetod vars säkerhet och tillförlitlighet förblir obevisad.
Ett bättre tillvägagångssätt skulle vara att omvandla den fångade CO 2 till användbara produkter som förädlade bränslen eller kemikalier. För detta ändamål, uppmärksamhet har fokuserats på elektrokemiska processer - i detta fall en process där kemiska reaktioner frigör elektrisk energi, som vid urladdning av ett batteri. Det ideala mediet för att utföra elektrokemisk omvandling av CO 2 verkar vara vatten. Vatten kan ge de protoner (positivt laddade partiklar) som behövs för att göra bränslen som metan. Men att driva sådana "vattenbaserade" (vattenbaserade) system kräver stora energiinsatser, och endast en liten del av de bildade produkterna är typiskt intressanta.
Betar Gallant, en biträdande professor i maskinteknik, och hennes grupp vid MIT har därför fokuserat på icke-vattenhaltiga (vattenfria) elektrokemiska reaktioner – i synnerhet, de som förekommer inuti litium-CO 2 batterier.
Forskning om litium-CO 2 batterier är i ett mycket tidigt skede, enligt Gallant, men intresset för dem växer eftersom CO 2 används i de kemiska reaktioner som sker på en av elektroderna när batteriet laddas ur. Dock, CO 2 är inte särskilt reaktiv. Forskare har försökt påskynda saker och ting genom att använda olika elektrolyter och elektrodmaterial. Trots sådana ansträngningar, behovet av att använda dyra metallkatalysatorer för att framkalla elektrokemisk aktivitet har bestått.
Med tanke på bristen på framsteg, Gallant ville prova något annat. "Vi var intresserade av att försöka få en ny kemi för att påverka problemet, "säger hon. Och tar hjälp av sorbentmolekylerna som så effektivt fångar upp CO 2 i CCS verkade vara en lovande väg att gå.
Att tänka om amin
Sorbentmolekylen som används i CCS är en amin, ett derivat av ammoniak. I CCS, avgaser bubblas genom en amininnehållande lösning, och aminen binder kemiskt CO 2 , ta bort det från avgaserna. Kompaniet 2 - nu i flytande form - separeras sedan från aminen och omvandlas till gas för bortskaffande.

Doktoranden Aliza Khurram förbereder sig för experiment genom att pumpa koldioxid genom en elektrokemisk cell bestående av litium- och kolelektroder plus en specialdesignad elektrolyt. Kredit:Stuart Darsch
I CCS, de sista stegen kräver höga temperaturer, som uppnås med en del av kraftverkets elektriska effekt. Gallant undrade om hennes team istället kunde använda elektrokemiska reaktioner för att separera CO 2 från aminen – och fortsätt sedan reaktionen för att göra ett fast ämne, CO 2 -innehållande produkt. Om så är fallet, bortskaffandet skulle vara enklare än det är för gasformig CO 2 . Kompaniet 2 skulle vara tätare packad, så det skulle ta mindre plats, och den kunde inte fly, så det skulle vara säkrare. Ännu bättre, ytterligare elektrisk energi kan utvinnas från anordningen när den urladdas och bildar det fasta materialet. "Visionen var att sätta en batteriliknande enhet i kraftverkets avfallsström för att binda den fångade CO 2 i en stabil fast substans, samtidigt som man skördar den energi som frigörs i processen, säger Gallant.
Forskning om CCS-teknik har genererat en god förståelse för kolavskiljningsprocessen som äger rum i ett CCS-system. När CO 2 tillsätts till en aminlösning, molekyler av de två arterna kombineras spontant för att bilda en "addukt, " en ny kemisk art där de ursprungliga molekylerna förblir i stort sett intakta. I det här fallet, addukten bildas när en kolatom i en CO 2 molekyl binder kemiskt till en kväveatom i en aminmolekyl. När de kombineras, kompaniet 2 molekylen är omkonfigurerad:den ändras från sitt ursprungliga, mycket stabil, linjär form till en "böjd" form med en negativ laddning - en mycket reaktiv form som är redo för ytterligare reaktion.
I hennes plan, Gallant föreslog att använda elektrokemi för att bryta isär CO 2 -aminaddukt - precis vid kol-kvävebindningen. Klyvning av adduktet vid denna bindning skulle separera de två bitarna:aminen i originalet, oreagerat tillstånd, redo att fånga mer CO 2 , och den böjda, kemiskt reaktiv form av CO 2 , som då kan reagera med elektronerna och positivt laddade litiumjoner som flödar under batteriladdning. Resultatet av den reaktionen kan vara bildningen av litiumkarbonat (Li 2 CO 3 ), som skulle avsättas på kolelektroden.
På samma gång, reaktionerna på kolelektroden bör främja flödet av elektroner under batteriets urladdning - även utan metallkatalysator. "Urladdningen av batteriet skulle ske spontant, " säger Gallant. "Och vi skulle bryta addukten på ett sätt som gör att vi kan förnya vår CO 2 absorberare när du tar CO 2 till ett stall, fast form."
En upptäcktsprocess
2016, Gallant och maskinteknik doktorand Aliza Khurram började utforska den idén.
Deras första utmaning var att utveckla en ny elektrolyt. En litium-CO 2 Batteriet består av två elektroder - en anod gjord av litium och en katod gjord av kol - och en elektrolyt, en lösning som hjälper till att transportera laddade partiklar fram och tillbaka mellan elektroderna när batteriet laddas och laddas ur. För deras system, de behövde en elektrolyt gjord av amin plus infångad CO 2 löst i ett lösningsmedel - och det behövde främja kemiska reaktioner på kolkatoden när batteriet laddas ur.
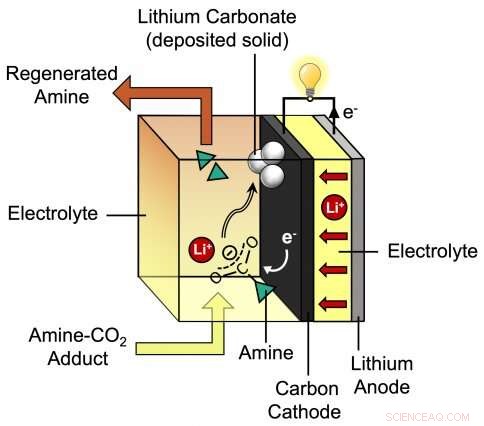
Detta diagram visar processen under urladdning av det nya litium-CO2-batteriet som utvecklats av MIT biträdande professor Betar Gallant och hennes grupp. Forskarnas föreslagna batteri består av en litiumanod plus en kolkatod som är omgiven av en speciell elektrolyt som innehåller litiumjoner (Li+) och amin. Upphovsman:Massachusetts Institute of Technology
De började med att testa möjliga lösningsmedel. De blandade sin CO 2 -absorberar amin med en serie lösningsmedel som ofta används i batterier och sedan bubblar CO 2 genom den resulterande lösningen för att se om CO 2 kan lösas vid höga koncentrationer i denna okonventionella kemiska miljö. Ingen av amin-lösningsmedelslösningarna uppvisade observerbara förändringar när CO 2 introducerades, vilket tyder på att de alla kan vara livskraftiga lösningsmedelskandidater.
Dock, för att alla elektrokemiska enheter ska fungera, elektrolyten måste spetsas med ett salt för att ge positivt laddade joner. Eftersom det är ett litiumbatteri, forskarna började med att tillsätta ett litiumbaserat salt – och experimentresultaten förändrades dramatiskt. Med de flesta lösningsmedelskandidater, tillsats av saltet fick omedelbart att blandningen antingen bildade fasta fällningar eller att bli mycket viskös - resultat som uteslöt dem som livsdugliga lösningsmedel. Det enda undantaget var lösningsmedlet dimetylsulfoxid, eller DMSO. Även när litiumsaltet var närvarande, DMSO kan lösa aminen och CO 2 .
"Vi fann att det litiumbaserade saltet, av en slump, var viktigt för att reaktionen skulle kunna fortsätta, " säger Gallant. "Det är något med den positivt laddade litiumjonen som kemiskt koordinerar med amin-CO 2 addukt, och tillsammans utgör dessa arter de elektrokemiskt reaktiva arterna."
Utforska batteriets beteende under urladdning
För att undersöka urladdningsbeteendet i deras system, forskarna satte upp en elektrokemisk cell bestående av en litiumanod, en kolkatod, och deras speciella elektrolyt - för enkelhetens skull, redan laddad med CO 2 . De spårade sedan urladdningsbeteendet vid kolkatoden.
Som de hade hoppats, deras speciella elektrolyt främjade faktiskt urladdningsreaktionen i testcellen. "Med aminen införlivad i den DMSO-baserade elektrolyten tillsammans med litiumsaltet och CO 2 , vi ser mycket hög kapacitet och betydande urladdningsspänningar - nästan tre volt, " säger Gallant. Baserat på dessa resultat, de drog slutsatsen att deras system fungerar som en litium-CO 2 batteri med kapacitet och urladdningsspänningar som är konkurrenskraftiga med de för toppmoderna litiumgasbatterier.
Nästa steg var att bekräfta att reaktionerna verkligen separerade aminen från CO 2 och fortsätta reaktionen för att göra CO 2 -avledda produkter. Att få reda på, forskarna använde en mängd olika verktyg för att undersöka de produkter som bildades på kolkatoden.

Denna bild med svepelektronmikroskop (SEM) visar katoden från forskarnas litium-koldioxidsystem efter urladdning. Analys av de sfäriska strukturerna bekräftar att de är sammansatta av Li2CO3. Insatsen visar en SEM-bild av kolkatoden före urladdning. Frånvaron av sfärerna bekräftar att de bildades under urladdningen. Upphovsman:Massachusetts Institute of Technology
I ett test, de producerade bilder av katodytan efter reaktion med hjälp av ett svepelektronmikroskop (SEM). Omedelbart uppenbara var sfäriska formationer med en karakteristisk storlek på 500 nanometer, regelbundet fördelat på katodens yta. Enligt Gallant, den observerade sfäriska strukturen för utsläppsprodukten liknade formen av Li 2 CO 3 observeras i andra litiumbaserade batterier. Dessa sfärer var inte uppenbara i SEM-bilder av den "orörda" kolkatoden tagna innan reaktionerna inträffade.
Andra analyser bekräftade att den fasta substansen avsatt på katoden var Li 2 CO 3 . Det inkluderade endast CO 2 -härledda material; inga aminmolekyler eller produkter härledda från dem fanns närvarande. Tagen tillsammans, dessa data ger starka bevis för att den elektrokemiska minskningen av CO 2 -belastad amin sker genom den selektiva klyvningen av kol-kvävebindningen.
"Aminen kan ses som att effektivt koppla på reaktiviteten hos CO 2 , " säger Gallant. "Det är spännande eftersom aminen som vanligtvis används i CO 2 capture kan då utföra två kritiska funktioner. Det kan fungera som absorbator, spontant hämta CO 2 från förbränningsgaser och införliva den i elektrolytlösningen. Och det kan aktivera CO 2 för ytterligare reaktioner som inte skulle vara möjliga om aminen inte fanns där."
Framtida inriktningar
Gallant betonar att arbetet hittills bara är en proof-of-concept-studie. "Det finns fortfarande mycket grundläggande vetenskap att förstå, " hon säger, innan forskarna kan optimera sitt system.
Hon och hennes team fortsätter att undersöka de kemiska reaktionerna som sker i elektrolyten samt den kemiska sammansättningen av adduktet som bildas - "reaktanttillståndet" på vilket den efterföljande elektrokemin utförs. De undersöker också saltkompositionens detaljerade roll.
Dessutom, det finns praktiska problem att tänka på när de tänker på enhetsdesign. Ett ihållande problem är att den fasta avlagringen snabbt täpper till kolkatoden, så ytterligare kemiska reaktioner kan inte inträffa. I en konfiguration undersöker de-en laddningsbar batteridesign-katoden upptäcks under varje laddningscykel. Reaktioner under utsläpp deponerar den fasta Li 2 CO 3 , och reaktioner under laddning lyfter av den, sätta litiumjonerna och CO 2 tillbaka in i elektrolyten, redo att reagera och generera mer el. Dock, den fångade CO 2 är sedan tillbaka i sin ursprungliga gasform i elektrolyten. Att täta batteriet skulle låsa den CO 2 inuti, bort från atmosfären - men bara så mycket CO 2 kan lagras i ett givet batteri, så den totala effekten av att använda batterier för att fånga upp CO 2 utsläppen skulle vara begränsade i detta scenario.

Forskarna använder den här inställningen för att testa lagringskapaciteten och urladdningsspänningen hos sina batterier. Kredit:Stuart Darsch
Den andra konfigurationen som forskarna undersöker - en uppsättning endast för utsläpp - löser det problemet genom att aldrig tillåta den gasformiga CO 2 att omforma. "Vi är maskiningenjörer, så vad vi verkligen är angelägna om att göra är att utveckla en industriell process där du på något sätt mekaniskt eller kemiskt kan skörda det fasta ämnet när det bildas, " säger Gallant. "Tänk dig om du genom mekanisk vibration försiktigt kunde ta bort det fasta ämnet från katoden, hålla den klar för ihållande reaktion." Placerad i en avgasström, ett sådant system kan kontinuerligt avlägsna CO 2 utsläpp, generera el och kanske producera värdefulla fasta material samtidigt.
Gallant och hennes team arbetar nu med båda konfigurationerna av deras system. "Vi vet inte vilket som är bäst för applikationer än, "säger hon. Medan hon tror att praktisk litium-CO 2 batterierna är fortfarande år borta, hon är exalterad över de tidiga resultaten, vilket tyder på att utveckla nya elektrolyter för att föraktivera CO 2 kan leda till alternativ CO 2 reaktionsvägar. Och hon och hennes grupp arbetar redan med några.
Ett mål är att ersätta litiumet med en metall som är billigare och mer jordnära, såsom natrium eller kalcium. Med startfinansiering från MIT Energy Initiative, teamet har redan börjat titta på ett system baserat på kalcium, ett material som ännu inte är välutvecklat för batteriapplikationer. Om kalcium-CO 2 installationen fungerar som de förutsäger, det fasta material som bildas skulle vara kalciumkarbonat - en typ av sten som nu ofta används i byggindustrin.
Sålänge, Gallant och hennes kollegor är glada över att de har hittat vad som verkar vara en ny klass av reaktioner för att fånga och binda koldioxid 2 . "CO 2 konvertering har studerats brett under många decennier, " hon säger, "så vi är glada över att tro att vi kan ha hittat något som är annorlunda och ger oss ett nytt fönster för att utforska detta ämne."
Den här historien återpubliceras med tillstånd av MIT News (web.mit.edu/newsoffice/), en populär webbplats som täcker nyheter om MIT-forskning, innovation och undervisning.