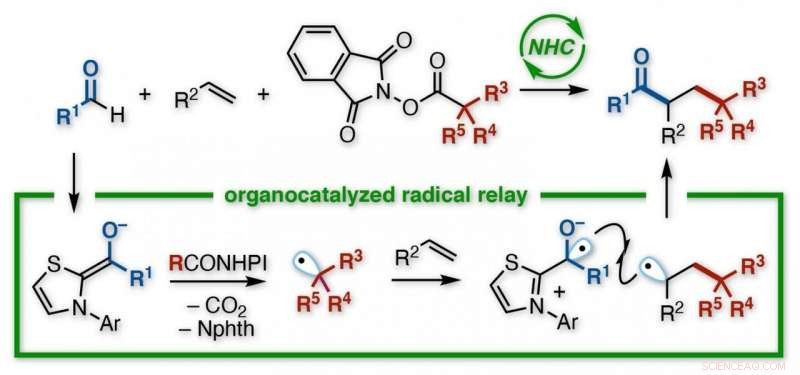
Ett japanskt forskargrupp vid Kanazawa University utvecklade en reaktion för att skapa funktionaliserade ketoner. Med hjälp av en N-heterocyklisk karben (NHC) organokatalysator, utan behov av metaller eller lätt bestrålning, en acyl och en alkylgrupp tillsätts tvärs över dubbelbindningen av en alken. NHC ger regioselektiv kontroll över en reläprocess som innefattar elektronöverföring följt av successiv tillsats av två radikaler till alkenen. De olika produkterna är användbara byggstenar för ytterligare synteser. Upphovsman:Kanazawa University
Organiska kemister är molekylära arkitekter, designa sofistikerade strukturer. När molekylerna som används inom vetenskap och medicin blir allt mer komplexa, nya verktyg behövs för att sätta ihop byggstenarna. Nu, ett japanskt team vid Kanazawa University har utvecklat en reaktion som kopplar ihop tre komponenter samtidigt med hjälp av fri radikal kemi.
Kol-kol dubbelbindningar, känd som alkener, är mer reaktiva än enkelbindningar. Detta gör dem användbara för att ansluta olika grupper:om dubbelbindningen bryts, två nya molekyler kan läggas till i vardera änden, överbryggas tillsammans av den nu enkelbundna före detta alkenen.
Kanazawa -teamet tittade på sätt att uppnå denna transformation med hjälp av aldehyder, som innehåller en dubbelbindning mellan syre och kol, som en av de två molekylerna ympade på en alken. Som rapporterats i Journal of the American Chemical Society , målet var att skapa starkt funktionaliserade ketoner, en viktig familj av föreningar i organisk syntes.
Deras valda metod var en känd reaktion, stämningsfullt nog, som ett radikalt stafett. Innehåller en oparad elektron, och därmed en halvtom orbital, radikaler (eller fria radikaler) tenderar att vara glupsk reaktiva. Så reaktiv, verkligen, att de inte kan lagras, men måste genereras på plats genom att piska av en elektron någonstans under en reaktion, gnistor en kaskad av bindande bryta och göra.
Kemister kan skapa radikaler på olika sätt, men Kanazawa-teamet ville testa en oraganokatalysator, kallad en N-heterocyklisk karben (NHC). Med en aldehyd som en reaktant, och en funktionaliserad redoxester som den andra, NHC utlöste deras omvandling till radikaler. Tidigare studier antydde att båda radikalerna skulle reagera snabbare med en alken än med varandra.
"Utmaningen med radikaler är att, vara så instabil, de reagerar ofta med sig själva, "säger studieförfattaren Kazunori Nagao." Då får du antingen tillbaka ditt utgångsmaterial, eller en biprodukt, istället för målet. Vi minimerade detta här. Faktiskt, reaktionen fortsatte som ett relä - först tillsattes alkylradikalen till ett kol av alkenen, och sedan tillsattes acylradikalen till den andra. "
Den resulterande föreningen hade en keton och en ester-härledd grupp bunden till två intilliggande kol, i ett så kallat vicinalarrangemang. Även om direkt reaktion mellan de olika radikalerna också inträffade-vilket gav en oönskad tvåkomponentsprodukt, istället för det alkenbryggade trekomponentmålet-det var mindre. Vidare, ett brett utbud av utgångsmaterial var kompatibla med processen.
"Två viktiga punkter är värda att nämna, "säger Hirohisa Ohmiya, motsvarande författare till studien. "Först, till skillnad från vissa reaktioner, vår är fri från metallkatalysatorer och behöver inte en ljuskälla för att producera radikaler, gör den grön och mångsidig. Andra, NHC styr exakt reläet, så vi kan vara selektiva i funktionerna hos funktionella grupper. Vi arbetar nu med en asymmetrisk version för kirala produkter. "