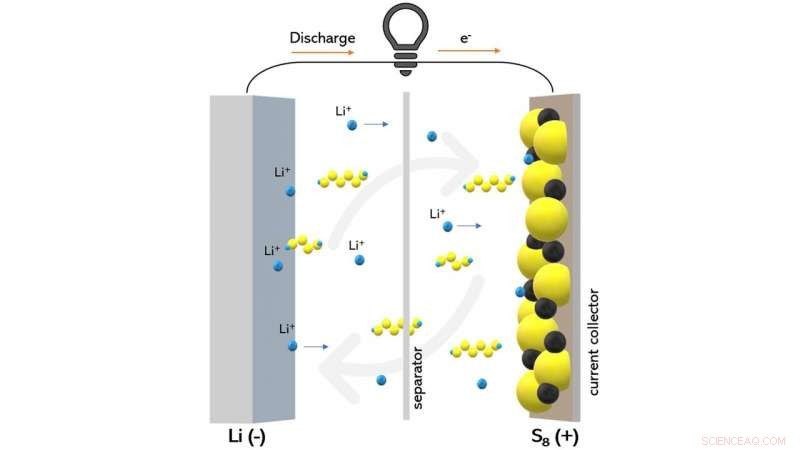
Detta diagram visar ett litium-svavelbatteri under urladdning. Forskare kunde observera hur en viss typ av elektrolytmaterial kan minska överföringen av polysulfidföreningar (visas som gula och blå kedjor) som försämrar batteriets prestanda. Kredit:Wikipedia/Creative Commons
Litiumjonbatterier representerar majoriteten av batterierna i hemelektronik och elfordon. I dag, forskare letar efter ny kemi som kan förbättra batteriernas energitäthet och prestanda utöver konventionella litiumjonbatterier.
En typ av dessa batterier, kallade litium-svavelbatterier, skulle kunna erbjuda mer energitäthet och lägre kostnad än det traditionella grafit/metalloxid litiumjonbatteriet. Dock, dess prestanda försämras ofta av en parasitisk reaktion som sker inuti batteriet som hindrar det från att cykla lika effektivt.
Nu, i en ny studie, forskare vid det amerikanska energidepartementets Argonne National Laboratory har upptäckt hur en viss klass av elektrolytmaterial kan minska frekvensen av denna reaktion, potentiellt banar väg för effektivare litium-svavelbatterier.
När ett litium-svavelbatteri laddas, en oundviklig bireaktion som kallas litiumpolysulfid-shuttling inträffar ofta. När batteriet laddas, litiumsulfid omvandlas till svavel på katoden, men vissa litium-svavelföreningar som är ofullständigt oxiderade kan lösas upp från katoden till elektrolyten - batteriets flytande område som skiljer de två elektroderna åt.
Vid denna tidpunkt, litium-svavelföreningarna kan diffundera och reduceras på anoden och oxidera tillbaka på katoden. Denna process kan gå om och om igen på ett sätt som slösar bort batteriets laddning utan att sätta det i arbete.
"Med polysulfidskytteln, du får inget ut av ditt batteri förutom att värma upp det, " sa Argonne kemisten Chi Cheung Su, en författare till studien. "I elektrokemiska termer, det är som att försöka flyga från New York till Los Angeles, men fastnar när jag reser fram och tillbaka mellan Chicago och Denver."
En stor del av orsaken till initieringen av polysulfidtransporten beror på att polysulfiderna lätt kan lösas upp i en elektrolyt som innehåller en lösningsmedelsblandning av två föreningar som kallas dioxolan (DOL) och dimetoxietan (DME). "Det finns två problem som vi måste lösa samtidigt - med låg löslighet och hög konduktivitet, " sa Su. "Genom att uppnå båda, vi kan föra dessa batterier närmare verkligheten."
Enligt Su, under de senaste fem åren eller så har en ny typ av elektrolytmaterial utvecklats som skulle kunna lösa båda dessa frågor. Detta material, kallas en hydrofluoreter, eller HFE, har en mycket lägre lösningsförmåga samtidigt som den bibehåller generellt god konduktivitet. "Det första steget för litium att komma till anoden innebär att lösa det i elektrolyten, ", sa han. "Som vatten är ett riktigt bra lösningsmedel för bordssalt, DME är ett mycket bra lösningsmedel för litium. Men med HFE är det som att försöka lösa upp salt i bensin."
Även om denna allmänna egenskap hos HFE har varit känd i flera år, Su och hans kollegor har kommit på ett allmänt sätt att förutsäga lösningsbeteendet och konduktiviteten hos denna klass av molekyler. Först, de delade upp dem i tre typer beroende på deras kemiska struktur. Vid mätning av hur elektrolyterna fungerade, forskarna noterade en viktig kompromiss:de kemier som visade det lägsta lösningsbeteendet och den minsta mängden polysulfid-shuttling hade också lägre konduktiviteter.
"Det visar att det inte finns någon magisk kula för litium-svavelbatterier ännu, och att vi fortfarande kommer att behöva fortsätta att hitta sätt att förbättra den kemi vi har, " sa Su.
En artikel baserad på forskningen, "En urvalsregel för hydrofluoreterelektrolytsamlösningsmedel:upprättande av ett linjärt fri-energiförhållande i litium-svavelbatterier, " dök upp i 13 maj-numret av Angewandte Chemie .