Kredit:Wiley
Vikningstillståndet hos proteinerna i levande celler speglar ofta cellens allmänna hälsa. Australiska forskare har utvecklat en molekylär sond som känner av proteomets tillstånd – hela uppsättningen av proteiner – genom att mäta proteinmiljöns polaritet. Sondens fluorescenssignal kvantifierar utvecklingen och dess kameleontliknande färgskiftning kartlägger de cellulära regionerna med förbättrad felveckning, säger studien publicerad i tidskriften Angewandte Chemie .
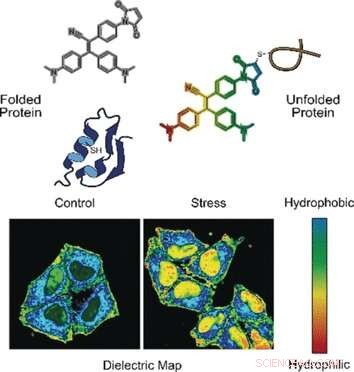
Om levande celler är stressade, proteinsyntes och vikningskorrigeringsmekanismer är i obalans. Felveckade proteiner förblir fast, ökad nedbrytning inträffar, och inaktiva proteiner och proteinrester aggregerar för att bilda granuler och kondensat i cytoplasman. Sådana aggregat spelar en viktig roll vid neurodegenerativa sjukdomar och cancer. En drivande faktor för aggregeringen av felveckade proteiner verkar vara polariteten - den elektroniska distributionen i en miljö. Yuning Hong och kollegor vid La Trobe University Melbourne och University of Melbourne, Australien, har designat en tvåmodal fluorogen sond för att övervaka proteinaggregation mer i detalj.
I ett läge, sonden känner av felveckade proteiner. Korrekt veckade proteiner stabiliseras ofta av broar gjorda av aminosyran cystein. Dessa broar är vanligtvis djupt begravda, medan felveckade proteiner exponerar cysteinresterna vid ytan. När sonden binder till cystein som exponeras av en felveckad proteinkedja, fluorescens slås på, förklara författarna.
I det andra läget, sonden bedömer polariteten. Polära miljöer indikerar en obalanserad elektronisk distribution, som kan mätas med dielektricitetskonstanten. För att mäta denna parameter, forskarna lade till en elektronisk "push-pull" kemisk grupp till den fluorogena sonden. De observerade att, i polära lösningar med hög dielektricitetskonstant, den fluorogena sonden som kallas NTPAN-MI avgav sin fluorescenssignal med ett färgskifte. Denna "kameleontliknande" färgförändring indikerar således en polaritetsförändring.
Författarna testade NTPAN-MI-sonden på en mänsklig cellinje, vilket de betonade genom att lägga till läkemedel som stör proteinsyntesen och veckningen. Forskarna observerade normal fluorescens i obehandlade celler, men ljus fluorescens när oveckade eller felveckade proteiner ackumulerades i celler behandlade med toxiner eller infekterade med virus. Dessutom, färgskiftningen signalerade omgivningens polaritet och därmed proteomtillståndet i varje cellulärt rum. Forskarna rapporterade att de visualiserade den "ovikta proteinbelastningen" i kärnan för första gången. Tidigare metoder kunde bara mäta oveckade proteiner i cytoplasman.
Med sina två avkänningslägen - mätning av utveckning och polariteten i proteinmiljön - ger NTPAN-MI-sonden en skarpare bild av stressreaktionerna från levande celler än vad som kan erhållas med endast enmodala sonder eller olika metoder. Författarna påpekar att deras metod skulle göra det möjligt för forskare att få mer exakt kunskap om överhörningen av de cellulära komponenterna som svar på stress.