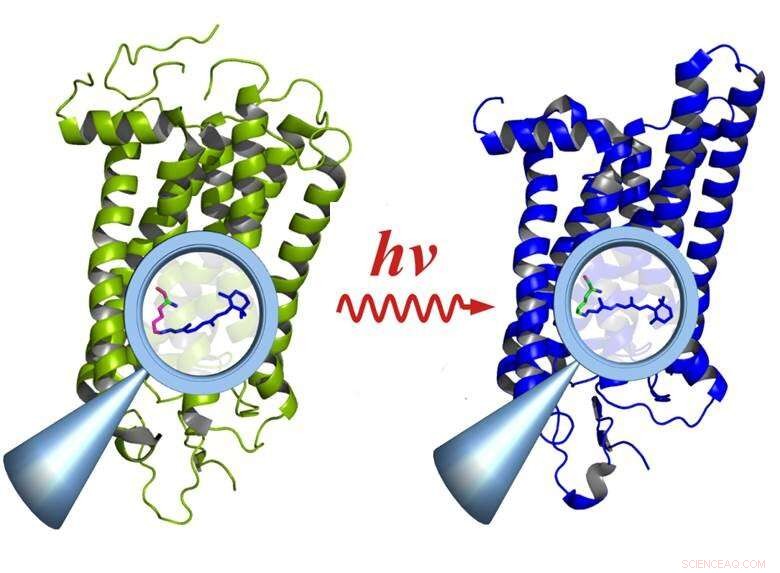
Rhodopsin före (vänster) och efter aktivering av ljus (höger):Aktiveringen orsakar förändringar i funktionella grupper inne i molekylen (förstoringsglas), som påverkar hela molekylen. Upphovsman:E. Ritter/HZB
Tidsupplöst infrarött spektroskopi i inter-millisekundintervallet är en viktig metod för att studera sambandet mellan funktion och struktur i biologiska molekyler. Dock, metoden fungerar bara om reaktionen kan upprepas många tusen gånger. Detta är inte fallet för ett stort antal biologiska processer, fastän, eftersom de ofta bygger på mycket snabba och irreversibla reaktioner, till exempel i syn. Individuella ljuskvanta som kommer in i näthinnans stavar aktiverar rhodopsinproteinmolekylerna, som sedan förfaller efter att ha fullgjort sin fototransduktionsfunktion.
Nu har ett team under ledning av Dr. Ulrich Schade (HZB) och Dr. Eglof Ritter (Humboldt-Universität zu Berlin) vid IRIS-strålen i BESSY II utvecklat ett nytt instrument som kan upptäcka denna typ av mycket snabba och/eller irreversibla reaktioner med en enda mätning. Tidsupplösningen är några mikrosekunder. Instrumentet, en Féry -spektrometer, använder en mycket känslig detektor som kallas en fokal-detektormatris och speciell optik för att optimalt utnyttja den lysande infraröda strålningen från BESSY II-synkrotronkällan. Teamet använde denna enhet för att observera aktivering av rhodopsin under nästan in vivo-förhållanden för första gången.
"Vi använde rhodopsin eftersom det irreversibelt sönderfaller efter att ha blivit upphetsad av ljus och därför är ett riktigt syratest för systemet, "förklarar Ritter, första författaren till studien. Rhodopsin är en proteinmolekyl som fungerar som en receptor och är synpigmentet som finns i stavarna i ögats näthinna. Även enstaka fotoner kan aktivera rhodopsin - vilket gör att ögat kan uppfatta extremt låga ljusnivåer. Dessutom, rhodopsin är det vanliga elementet i en klass av receptorer med hundratals medlemmar som är ansvariga för lukt, smak, trycksensation, hormonmottagning, etc. — som alla fungerar på liknande sätt.
Teamet studerade också ett annat spännande protein i det infraröda området för första gången:actinorhodopsin. Denna molekyl kan omvandla ljusenergi till en elektrisk ström - en egenskap som vissa bakterier använder för att generera elektrokemisk energi för sina ämnesomsättningar.
"Den nya metoden gör det möjligt för oss att undersöka molekylära reaktionsmekanismer för alla irreversibla processer (eller långsamma cykliska processer), t.ex. inom energiomvandling och lagring, till exempel, "framhöll Schade, som leder IRIS -teamet.