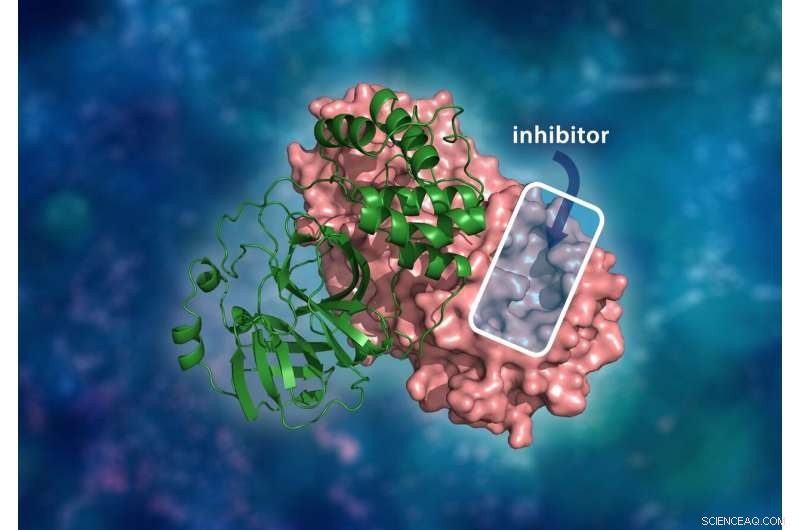
Den tredimensionella strukturen av SARS-CoV-2 huvudproteas. Det molekylära dimerkomplexet består av en enda monomer (grön) bunden till en annan monomer (rosa) där en läkemedelshämmare skulle binda till en katalytisk platshålighet för att förhindra viruset från att replikera. Kredit:ORNL/Andrey Kovalevsky, Jill Hemman
När det nya coronaviruset fortsätter att spridas, forskare letar efter nya sätt att stoppa det. Men för två vetenskapsmän, att se mot framtiden innebär att hämta inspiration från det förflutna.
I januari 2020, Andrey Kovalevsky och Daniel Kneller, forskare vid Department of Energy's (DOE:s) Oak Ridge National Laboratory (ORNL), förberedde sig på att använda neutroner för att studera förhållandet mellan ett visst HIV-proteas – ett proteinenzym som gör att viruset kan replikera sig självt i människokroppen – och en klass av antiretrovirala läkemedel som kallas HIV-proteashämmare. Vissa typer av HIV bygger resistens mot dessa läkemedel. Forskarnas mål var att få en bättre förståelse för hur proteasvariationer fungerar, för att hjälpa utvecklingen av banbrytande behandlingar för att övervinna även de tuffaste resistenta hiv-stammarna.
När teamet började sitt arbete, lite visste de att, av en slump, deras ansträngningar att studera hiv skulle snabbt sätta dem på en ny väg för att tackla covid-19, pandemin som nu har världen i sitt grepp.
Som det visar sig, den enzymatiska proteasaktiviteten som gör det möjligt för HIV att fortplanta sig – själva mekanismen som Kovalevskys team förberedde sig för att undersöka med neutroner – är samma replikationsmekanism som används av SARS-CoV-2, viruset som orsakar sjukdomen COVID-19.
Nu, teamet har flyttat fokus för det experimentella tillvägagångssätt de tänkt använda för att studera hiv för att bekämpa det nya globala hotet.
HIV-studier svänger till det nya coronaviruset
Kovalevsky har studerat hiv i 15 år. Som neutronkristallograf, han studerar små kristalliserade prover av biologiskt material genom att bombardera dem med neutroner. Neutronspridningstekniken är mycket effektiv för att avslöja hur ett provs atomstruktur är ordnad och hur dess atomer beter sig. Beroende på syftet, insikter som samlats in kan ge vägledning om hur man antingen förbättrar eller till och med undertrycker vissa egenskaper hos ett biologiskt material.
Neutroner är ett idealiskt verktyg för att studera biologiska strukturer och beteenden på grund av deras akuta känslighet för lätta element som väte och deras förmåga att undersöka sådana material utan att skada dem.
Under 2019, Kovalevsky satte sig för att studera hiv på ett sätt som aldrig tidigare gjorts. Att använda oelastisk neutronspridning skulle tillåta honom att samla in data om dynamiken, eller rörelserna, av ett HIV-proteas, vilket skulle lägga till neutrondiffraktionsdata han hade samlat in i flera år. Att ha både strukturell och beteendemässig – eller dynamisk – information skulle ge en mer komplett bild av hur viruset fungerar och, i tur och ordning, kan leda till nya framsteg inom behandlingar.
Efter att ha använt VISION-spektrometern vid ORNL:s Spallation Neutron Source (SNS) – ett neutronspridningsinstrument som avslöjar atomernas rörelser baserat på deras vibrationer – insåg Kovalevsky att han behövde hjälp med att analysera data.
"Daniel tar in expertis inom viral proteasforskning, " förklarade Kovalevsky om att rekrytera Kneller. "Han vet hur man arbetar med proteinerna i labbet. Han kan alla labbtekniker när det gäller proteinproduktion, rening, kristallisation, kristallografisk datainsamling, och analys för att få insikter i läkemedelsdesign."
Det tog cirka 8 månader att anställa Daniel efter en omfattande sökning, säger Kovalevsky. Kneller – som är specialiserad på att studera HIV-proteas med hjälp av kristallografi – gick med i Kovalevskys team i januari 2020 för att hjälpa till med det experimentella och beräkningsmässiga arbetet med HIV-proteaset.
Men precis när laget var redo att dyka in, COVID-19 hade blivit global, och forskningen fick ett hårt stopp.

Postdoktorn Daniel Kneller använder ORNL:s centrum för strukturell och molekylär biologi för att syntetisera kristalliserade proteiner relaterade till COVID-19 och förbereda dem för neutronspridningsstudier vid Spallation Neutron Source och High Flux Isotope Reactor. Kredit:ORNL/Carlos Jones
Växla, få tidiga resultat
I mars, personal i ORNL:s Neutron Sciences utvecklade en plan för att studera nyckelkomponenter i COVID-19 genom att sammansätta forskargrupper och omprioritera driftscheman för viktiga instrument vid de två neutronspridningsanläggningarna på ORNL, SNS och High Flux Isotope Reactor (HFIR).
Efter att redan ha lagt grunden för att studera proteas, Kovalevsky och Kneller gick omedelbart från HIV till det nya coronaviruset. Specifikt, de är för närvarande fokuserade på huvudproteaset av SARS-CoV-2, viruset som orsakar covid-19-sjukdomen.
"SARS-CoV-2-proteaset är ett enzym som skär ut proteiner som gör att viruset kan fortplanta sig. Att förstå hur proteaset är sammansatt och hur det fungerar är ett kritiskt första steg för att hitta effektiva läkemedelshämmare för att blockera virusets replikationsmekanism, ", sa Kovalevsky. "Liknande med HIV-proteaset, huvudproteaset från SARS-CoV-2-viruset är ett av de mest attraktiva läkemedelsmålen just nu för att utforma specifika inhibitorer."
Som med den ursprungliga planen för hiv-arbetet, teamet förbereder sig för att använda instrument vid SNS och HFIR för att få grundläggande insikter om hur atomerna i proteaset är ordnade. Med hjälp av instrumenten ManDi och IMAGINE, forskarna kommer att kunna sätta ihop proteasets atomstruktur genom att använda neutroner för att spåra väteatomerna i de kristalliserade proteinproverna.
Men först, de måste få kristaller av hög kvalitet som är tillräckligt stora för neutronexperiment. Det är här laget har tagit betydande framsteg tidigt.
Kristallkvaliteten bestäms först av hur väl de diffrakterar, eller strö, Röntgenstrålar. Vanligtvis, denna process utförs vid en synkrotronanläggning, där kristallerna kan frysas till cirka 100 K (eller cirka -280 °F).
Teamet använde Protein Crystallization and Characterization-labbet vid SNS för att odla SARS-CoV-2-proteaskristaller, vilket tog ungefär en vecka till 10 dagar. För att analysera kvaliteten på kristallerna, de använde den lokala röntgenmaskinen, ett Rigaku HighFlux HomeLab, vilket gav flera viktiga resultat.
Först, röntgenexperimenten bekräftade att kristallerna var av hög kvalitet och att metoden som användes för att odla dem kunde ge större kristaller lämpliga för neutronexperiment. Andra, att ha en lokal maskin gjorde det möjligt för dem att samla in röntgenmätningar vid rumstemperatur, runt 70°F.
Rumstemperaturmätningarna gjorde det möjligt för dem att observera plasticiteten, eller flexibilitet, av proteasstrukturen, ger urskiljbar information om hur strukturen beter sig under förhållanden nära virusets fysiologiska miljö. Dessa uppgifter kunde inte ha erhållits med frysta prover.
"Detta är en viktig milstolpe i vår ansträngning att göra neutrondiffraktion. Investeringen i en lokal röntgenmaskin har gett rätt bra resultat, sade Kneller. I ett fall, vi odlade kristaller på måndagen och samlade in data om dem på tisdagen. Annat, för att få den informationen måste du skicka dina kristaller till en synkrotron, som kan ta dagar till veckor."
"Och just nu, på grund av pandemin, du kan inte gå till en synkrotron, " tillade Kovalevsky. "Och för att analysera kristaller vid rumstemperatur, du måste vara där."
"Informationen vi lärde oss från rumstemperaturstrukturen har förmågan att omedelbart påverka de beräkningsriktningar som forskare använder. Vi hittade några skillnader mellan vår rumstemperatur nära-fysiologiska struktur och de frusna strukturerna från synkrotronerna, vilket kan vara viktigt för beräkningsarbetet, som de små molekylära dockningsstudierna som görs på ORNL:s superdator Summit, sa Kneller.

Mikroskopisk bild av SARS-CoV-2-proteaskristallerna odlade i ORNL:s proteinkristallisations- och karaktäriseringslaboratorium. När kristaller når en viss storlek och form, de kommer att användas i neutronspridningsexperiment för att bestämma hur SARS-CoV-2-huvudproteaset är uppbyggt och hur det beter sig. Kredit:ORNL/Daniel Kneller
"Än så länge, vi har varit mycket framgångsrika i våra tidiga studier av covid-19. Vi har redan skickat in ett manuskript för publicering om våra strukturella fynd, där vi i huvudsak har genomfört två månaders forskning som normalt kan ha tagit ett år."
Leighton Coates hjälpte Kovalevsky och Kneller i data- och strukturanalysen av proteinkristallerna, en instrumentforskare på SNS MaNDi-diffraktometern som också är medlem i det kristallografiska teamet som studerar SARS-CoV-2-proteaset.
Data som genereras under de kommande månaderna kommer att delas med andra nationella laboratorier, universitet, och det bredare vetenskapssamhället för att bygga mer exakta modeller för beräkningssimuleringar som används för att identifiera potentiella läkemedelskandidater för att stoppa viruset.
"Det vetenskapliga samfundet har reagerat snabbt på covid-19-pandemin. Vi har turen att kunna ge våra egna bidrag genom att utnyttja år av erfarenhet av att studera HIV för att bygga en bättre förståelse för hur det nya coronaviruset replikerar och hur vi kan bekämpa det genom att hämmar dess väsentliga proteas, sa Kovalevsky.
Forskar om HIV-resistens
Innan pandemin vände sin uppmärksamhet och ansträngningar till att undersöka SARS-CoV-2, Kovalevsky och Kneller hade en tydlig plan för att attackera hiv.
Trettio-nio miljoner människor runt om i världen är infekterade med HIV. Att ge dessa människor bättre behandlingsalternativ skulle inte bara förbättra deras livskvalitet utan också förhindra att denna sjukdom sprids ytterligare.
HIV-proteaset fungerar genom att klyva ofarligt, eller icke-funktionell, strängar av proteiner till mindre proteiner, omvandla dem till funktionella virala proteiner som gör att viruset kan samlas och fortsätta att infektera friska mänskliga celler. I allmänhet, HIV-proteashämmare är ganska effektiva för att blockera proteas under HIV-replikation, men vissa varianter av proteas har utvecklat en förmåga att motstå läkemedelshämmare.
"Om vi kan lära oss mer om de molekylära mekanismerna som gör HIV-proteasvarianter läkemedelsresistenta, vi kan designa läkemedel som är bättre rustade att överlista dess försvar, sa Kneller.
Specifikt, Kneller och Kovalevsky ville utforska PRS-17, en unik HIV-proteasvariant som är 10, 000 gånger mindre sannolikt än andra icke-resistenta varianter att hämmas av de mest effektiva kliniska HIV-proteashämmarna som finns tillgängliga för närvarande. Kovalevsky förklarade att även om hiv-behandlingsprogram har kommit långt sedan hiv-pandemin började på 1980-talet, mutanta varianter som PRS-17, till följd av långvarig behandling, kan äventyra år av farmaceutisk innovation och framsteg och resultera i misslyckade antivirala terapier.
"Drogresistens är nu det största problemet för HIV-patienter. Med rätt behandling, patienter kan leva långa och lyckliga liv med oupptäckbara nivåer av hiv i deras system. De kommer inte att utveckla AIDS eller sprida hiv till andra. Men PRS-17 och andra läkemedelsresistenta HIV-proteasvarianter gör det svårt för läkare att bekämpa HIV hos sina patienter, sa Kovalevsky.
Att förstå exakt hur PRS-17 neutraliserar effekten av HIV-proteashämmare är svårt, säger forskarna. Viruss ingående proteiner är komplexa system, och PRS-17 har förmågan att använda flera olika mekanismer för att skydda sig mot antiretrovirala läkemedel.
"Att ta reda på hur PRS-17 motstår HIV-proteashämmare är en utmaning, men en som vi absolut måste övervinna. PRS-17 är ett kliniskt isolat, vilket betyder att det kom från en verklig patient som kämpar för att bekämpa denna sjukdom, " förklarade Kneller. "Att lära sig mer om det kan rädda livet på många patienter, eftersom kunskapen vi får med neutroner på PRS-17 kommer att kunna överföras till andra liknande extremt läkemedelsresistenta proteasvarianter."
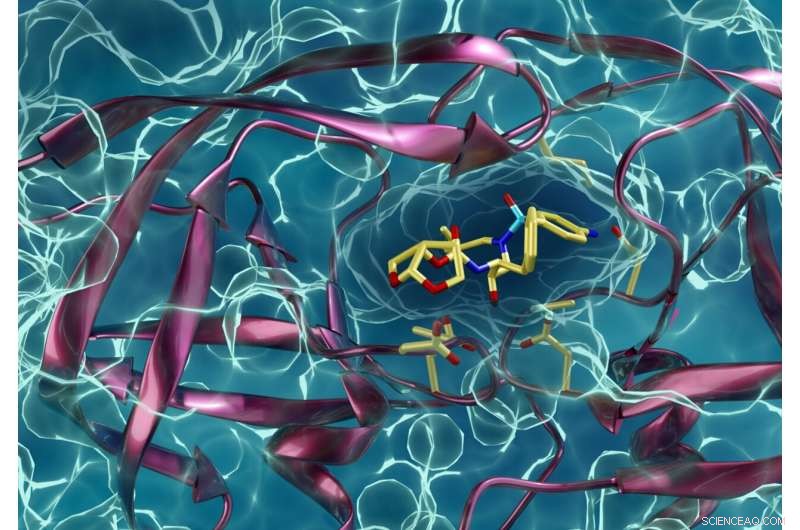
En läkemedelsresistent typ av HIV-proteas som interagerar med en HIV-proteashämmare. Kneller och Kovalevsky hoppas att samma tekniker som de har använt för att lära sig mer om hiv också kommer att hjälpa andra forskare att bekämpa covid-19. Kredit:ORNL/Jill Hemman
Teamet hade för avsikt att skapa en karta över PRS-17-proteaset för att bättre förstå de molekylära mekanismerna bakom dess läkemedelsresistens. Det innebar att använda instrumenten ManDi och VISION på SNS och instrumentet IMAGINE på HFIR.
"Det var i stort sett samma tillvägagångssätt som vi nu försöker med COVID-19, sa Kovalevsky.
Med MaNDi och IMAGINE, Kneller och Kovalevsky planerade att undersöka kristalliserade prover av PRS-17-proteas för att generera detaljerade data om dess statiska atomstruktur. Att använda VISION skulle göra det möjligt för dem att undersöka pulveriserade prover av PRS-17-proteas för att ge insikter om dess dynamiska egenskaper genom att mäta molekylära vibrationer.
Neutroner är särskilt väl lämpade för att studera komponenter i virus som HIV (eller SARS-CoV-2) på grund av deras känslighet för väte, en viktig komponent i alla proteiner. Med neutronkristallografi, teamet kunde exakt lokalisera varje väteatom i PRS-17s proteas, ge dem oöverträffad insikt i hur proteinet fungerar och vilka interaktioner det genomgår med en proteashämmare.
"Använd neutronkristallografi vid MaNDi och IMAGINE för att lokalisera väteatomer i kristaller av PRS-17-proteas, skulle göra det möjligt för oss att bygga en heltäckande profil av dess statiska struktur, " sade Kneller. "Med VISION, vi skulle också spåra väteatomer, men vi skulle använda pulveriserade prover av PRS-17-proteas som har rehydrerats för att efterlikna de trånga förhållandena för en HIV-viruspartikel. Det skulle tillåta oss att se dess dynamiska egenskaper och lära oss mer om hur den kan röra sig när den arbetar i en viral partikel."
Kneller förklarade att det är viktigt att få information om både de statiska och dynamiska egenskaperna hos PRS-17 för att utveckla en fullständig förståelse för detta viruss resistens mot antiretrovirala läkemedel.
"Om jag spårade din plats bara en gång om dagen vid midnatt, Jag skulle tro att du spenderar all din tid hemma. Men på riktigt, du rör dig ganska mycket under dagen. Det är därför det är viktigt att samla in både statiska och dynamiska mätningar av vårt prov. Det låter oss bygga en mer fullständig bild av proteasens beteende, sa Kneller.
"Utan neutronkristallografi, forskare måste göra välgrundade gissningar om var väteatomer finns i ett protein när de försöker förstå hur proteinet gör sitt jobb, ", tillade Kneller. "Dessa typer av experiment som Andrey har gjort tidigare har faktiskt kunnat bekräfta placeringen av dessa väteatomer i icke-resistenta HIV-proteasvarianter, men aldrig i en extremt läkemedelsresistent proteasvariant. Det betyder att vi skulle kunna producera helt unika och nya data om detta proteas."
Kneller och Kovalevsky hoppas att en dag generera data genom sina experiment som kommer att bli en ovärderlig resurs för forskare som vill bekämpa läkemedelsresistenta stammar av HIV.
"Det är ett lagarbete. Kemister, biologer, och yrkesverksamma från läkemedelsindustrin måste alla arbeta tillsammans för att bekämpa sjukdom, sade Kneller. Tillsammans, vi kan utveckla effektiva behandlingar för läkemedelsresistenta stammar av HIV."
Forskning stöddes av DOE Office of Science genom National Virtual Biotechnology Laboratory, ett konsortium av DOE nationella laboratorier fokuserade på svar på covid-19, med finansiering från Coronavirus CARES Act.