Ett diagram som illustrerar acetylering av Pif1 -helikasenzymet Credit:Matthew Bochman och Lata Balakrishnan, Indiana University Bloomington/IUPUI
En ny studie ledd av forskare vid IUPUI och Indiana University Bloomington är den första som beskriver en biokemisk mekanism som ökar aktiviteten hos en molekyl vars närvaro observeras i många typer av cancer.
Molekylen, ett enzym som kallas Pif1helicase, spelar en roll i många viktiga cellulära processer i kroppen. Att strikt reglera detta protein är avgörande för genomets stabilitet eftersom för lite eller för mycket aktivitet kan påverka åldrande och åldersrelaterade sjukdomar, främst cancer. En vanlig cancerterapi, HDAC-hämmare, kan också utlösa en topp i detta enzym.
"För närvarande, vi ger människor droger som ökar Pif -aktiviteten utan att helt veta hur det påverkar andra delar av cellen som spelar en roll för genomstabilitet, sa Lata Balakrishnan, en docent i biologi vid School of Science vid IUPUI, som är medledande författare till studien.
"HDAC-hämmare uppreglerar vissa tumörhämmande gener, och används därför i kombinationsbehandlingar för att behandla specifika cancerformer, men när det kommer till deras inverkan på andra delar av cellen, vi arbetar i princip i mörker."
Studiens andra huvudförfattare är Matthew Bochman, docent vid IU Bloomington College of Arts and Sciences avdelning för molekylär och cellulär biokemi. Andra medförfattare är Christopher Sausen och Onyekachi E. Ononye, Ph.D. studenter i Bochmans och Balakrishnans labb, respektive, vid tidpunkten för studien.
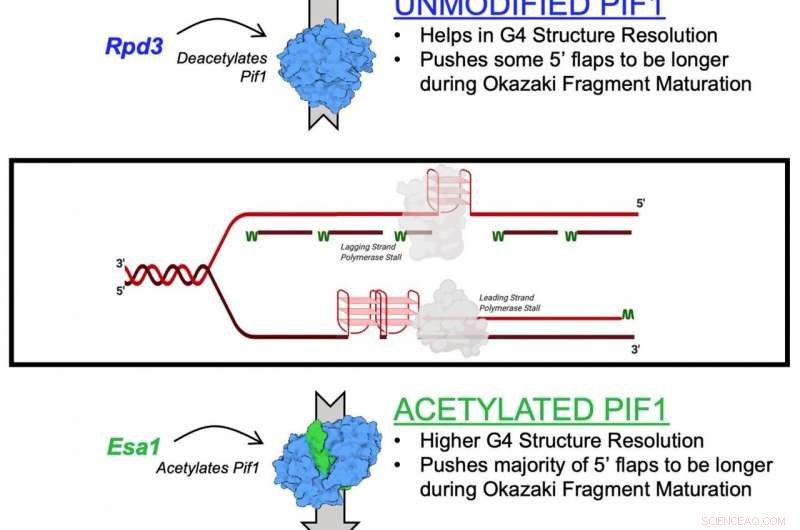
Mekanismen som beskrivs i studien är effekten av lysinacetylering på Pif1. Lysinacetylering uppstår när en liten molekyl som kallas en acetylgrupp binder till lysin, en aminosyra som används för att bygga vanliga proteiner i kroppen. Denna åtgärd omvandlar lysin från en positivt laddad molekyl till en neutralt laddad molekyl. Denna neutralisering kan påverka proteinfunktionen, proteinstabilitet och protein-proteininteraktion i celler, bland annat.
Helikaser är kända som de genetiska "blixtlåsen" hos celler eftersom de drar isär DNA för genetisk replikering och reparation. De hjälper också till att upprätthålla telomerer, strukturen i slutet av kromosomerna som förkortas när människor åldras.
I den nya studien, forskarna identifierade lysinacetylering på Pif1-helikas och visade att tillsatsen av acetylgruppen ökar proteinets aktivitet – såväl som dess "upplåsande" funktion. De fann också att lysinacetylering ändrar formen - eller "konformationen" - av Pif1-proteinet. De tror att denna formförändring ökar mängden Pif1-helikas.
"Det dynamiska samspelet mellan tillägg och avlägsnande av acetylgruppen på lysin reglerar en mängd olika proteiner i cellen, ", sa Balakrishnan. "Störningar i denna process kan spela en roll vid cancer, åldrande, inflammatoriska reaktioner och till och med beroenderelaterade beteenden."
"Som klass, helikaser är involverade i många processer som är nödvändiga för genomets integritet, "Tillade Bochman." Varje signifikant misslyckande i dessa processer är i allmänhet cancerframkallande. "
De exakta detaljerna för lysinacetylering i Pif1, dess effekt av enzymets form och den resulterande effekten på helikasaktivitet tog nästan fem år att observera och rapportera. Studien, genomförs parallellt på två IU -campus, möjliggjordes av de ledande forskarnas kompletterande expertis. Som biokemist som tidigare har studerat lysinacetylering i andra proteiner, Balakrishnan kunde isolera Pif1 in vitro för att observera dess svar på kemiska reaktioner i ett provrör. I kontrast, som en genetiker som arbetar i jäst som en modellorganism för att studera Pif1, Bochman kunde modifiera celler in vivo för att se reaktioner utspela sig i en levande organism.
"Förmågan att observera dessa reaktioner i en levande cell är ofta mer relevant, men det är också mycket stökigare, " sa Balakrishnan. "Våra experiment informerade ständigt varandra om vart de skulle gå härnäst."
Med blicken mot framtiden, Bochman sa att intrikat kunskap om cellulära processer - såsom lysinacetylering - kommer att spela en alltmer roll i personlig terapi.
"Om du sekvenserar en patients tumör, du kan finjustera läkemedel för att rikta in sig på mycket specifika enzymer, "sa han." I stället för ett läkemedel som i stort påverkar hela cellen, det kommer att vara möjligt att ta ett riktat tillvägagångssätt som minskar potentiella biverkningar. Denna nivå av personalisering är verkligen framtiden för cancerbiologi och cancermedicin."