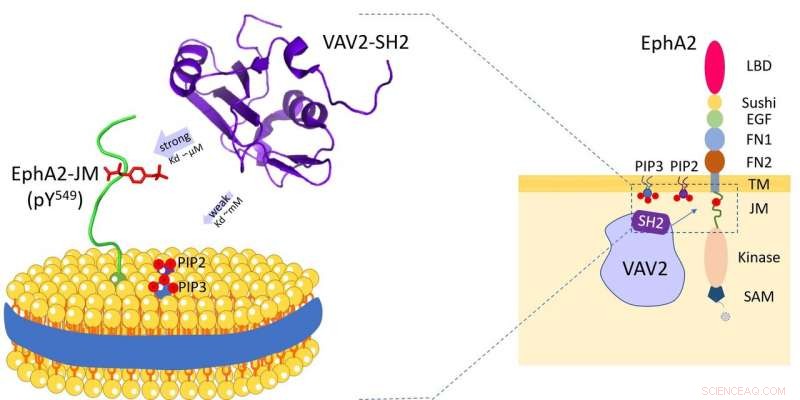
Vav2 -protein binder till cellmembranfosfolipider och receptortyrosinkinas EphA2 -juxtamembranregionen. Kredit:HFIPS
Nyligen, ett forskargrupp som leds av professor Wang Junfeng från High Magnetic Field Laboratory, Hefei Institutes of Physical Science avslöjade Vav2-SH2-proteinets dubbla specificitet efter att ha undersökt den specifika igenkänningsmekanismen för humant Vav2-protein med cellmembranfosfolipider och receptortyrosinkinas EphA2-juxtamembranregionen.
Vav2 uttrycks i stort i mänskliga vävnader och spelar viktiga roller i olika biologiska processer. Och genom sin Src-homology 2 (SH2) domän, Vav2 kan interagera med flera transmembranreceptorer. Dessa SH2-medierade interaktioner äger rum på eller nära plasmamembranet och är väsentliga för Vav2 att förmedla olika extracellulär signaltransduktion.
I denna forskning, med hjälp av kärnmagnetisk resonans (NMR) teknik, forskarna upptäckte fosfolipidmiljöns roll på protein-proteininteraktion, erbjuder en potentiell metod för att studera denna interaktion i samma miljö under nära fysiologiska förhållanden.
Forskarna avslöjade att Vav2-SH2-domänen specifikt binder till Y594-fosforylerade juxtamembranregionen med hjälp av sitt konserverade proteinbindningsställe. Intressant, den hade också fosfolipidbindningsförmågan och fosfolipidbindningsstället för Vav2-SH2, intill proteinbindningsstället, bestämdes genom NMR -experiment.
Vidare, forskarna använde lipid -nanodiskar för att efterlikna membranet, och avslöjade membranmiljöns roll vid modulering av detta protein-proteinigenkänning.