Proteinmål Kredit:Elena Khavina/MIPT
Forskare från MIPT och flera amerikanska och kinesiska universitet har löst strukturen av ett av de viktigaste nervsystemets proteiner i komplex med ett antal läkemedelsmolekyler. Upptäckten öppnar möjligheter för att utveckla nya läkemedel med reglerad verkan och färre biverkningar. Uppsatsen publicerades i tidskriften Cell .
Många moderna läkemedel riktar sig mot proteiner eftersom de är ansvariga för de flesta av de fysiska och kemiska reaktionerna i en cell. Proteinmolekyler gör det också möjligt för celler att kommunicera genom att överföra signaler mellan dem. När en person blir sjuk, harmonin i cellerna störs, så läkemedel används för att återställa balansen genom att tillfälligt öka eller minska aktiviteten hos proteiner. Många av dem fyller liknande funktioner och har nästan identiska strukturer, vilket innebär att ett läkemedel kan påverka flera proteintyper. Denna förmåga hos läkemedel att interagera med flera proteinmål kallas polyfarmakologi.
När det molekylära tillvägagångssättet för läkemedelsutveckling först introducerades, en allmän uppfattning bland farmakologer var att läkemedlets effektivitet berodde på hur ett visst läkemedel interagerade med ett givet protein. Interaktionen med andra proteintyper, dock, ansågs endast orsaka negativa biverkningar. Så då, huvudsyftet med farmakologi var att maximera selektiviteten – dvs. ett läkemedels förmåga att endast rikta in sig på en specifik typ av proteiner. Konceptet fick ett metaforiskt namn från Nobelpristagaren Paul Ehrlich som myntade termen "magiska kulor" för att referera till sådana mycket selektiva mediciner.
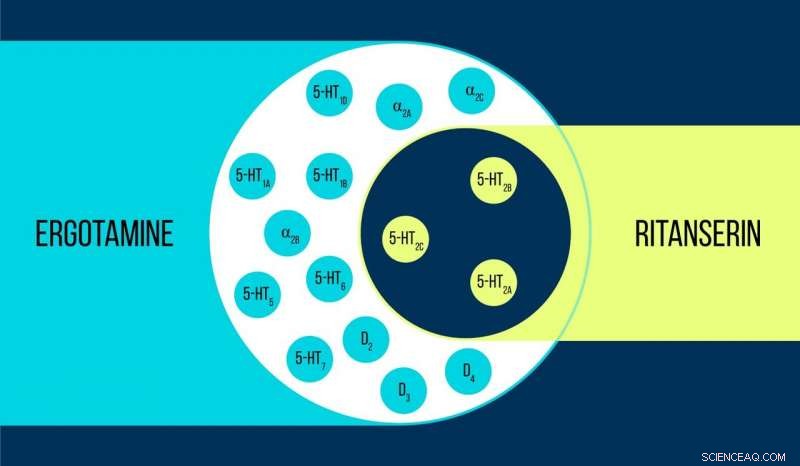
Jämförelse av ergotamin och ritanserin Kredit:Elena Khavina/MIPT
Dock, som det ofta händer, det enklaste konceptet är inte nödvändigtvis det mest framgångsrika. Framsteg inom datorteknik inom kemi och biologi gjorde det möjligt att producera extremt selektiva läkemedel som endast verkade på två eller tre nära subtyper av ett målprotein. Men de var inte lika effektiva som deras lågselektivitetsanaloger vid behandling av komplexa sjukdomar som depression:De polyfarmakologiska profilerna för vissa läkemedel visade sig vara viktiga för deras gynnsamma effekter. Det visade sig att polyfarmakologi inte nödvändigtvis orsakar negativa biverkningar, ändå är det viktigt att kontrollera vilka proteiner som påverkas. Uppfattningen om en "magisk kula" ersattes alltså av konceptet "magic shotgun", som betonar läkemedel med önskad effekt på en viss kombination av mål.
Syftet med denna forskning var att identifiera de strukturella egenskaperna hos proteiner som skulle förklara varför vissa läkemedel verkar selektivt på dem och andra inte. För att genomföra studien, forskarna använde 5-HT2c serotoninreceptorn – ett signalprotein som finns i cellmembranet, som aktiveras av serotonin för att ta emot signaler från närliggande celler. Receptorn har ett antal viktiga egenskaper. Först, det används redan som ett validerat mål för medicin mot fetma, samtidigt som det är ett potentiellt terapeutiskt mål för flera psykiska störningar. Andra, det är inriktat på ett antal mediciner med ett brett utbud av selektiviteter, gör det möjligt att jämföra dem. För det tredje, en människokropp har över 800 andra receptorer som liknar strukturen för 5-HT2c men har olika funktioner. Det är därför som dess icke-selektiva antagonister ofta har en mängd biverkningar.
Vsevolod Katritch, gästprofessor vid MIPT, säger, "Vi använde två kemikalier för att arbeta med 5-HT2c serotoninreceptorn:ergotamin och ritanserin. Ergotamin är en icke-selektiv agonist med en bred polyfarmakologisk profil:Det påverkar serotonin, dopamin, och adrenerga receptorer. Ritanserin, däremot har en smalare profil [figur 1] och är den 5-HT2c-receptorselektiva omvända agonisten. Således, 5-HT2c-atomstrukturerna erhållna i komplex med ergotamin och ritanserin hjälper inte bara att förklara skillnaderna mellan aktiva och inaktiva receptortillstånd - vilket i sig är en betydande prestation - utan också ta reda på orsakerna till sådan molekylär selektivitet."
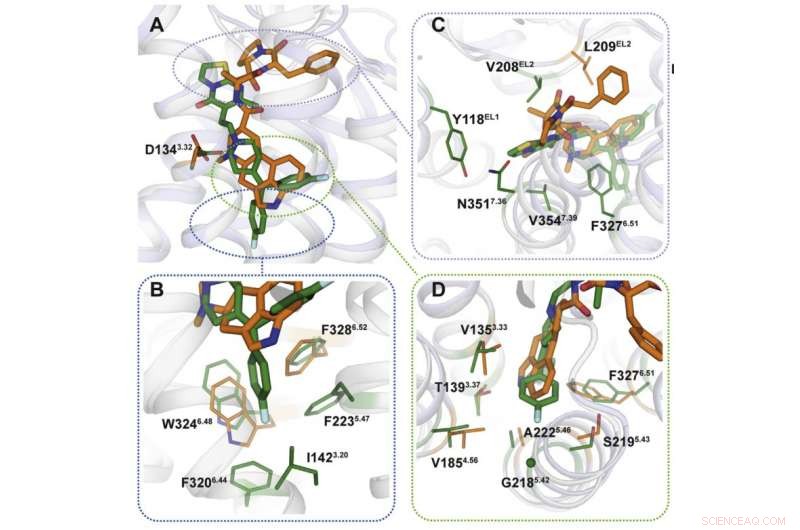
Kredit:Moscow Institute of Physics and Technology
Med hjälp av röntgenkristallografi, forskarna fick en 3D-modell av proteiner i ögonblicket av deras interaktion med läkemedel. Förutsägbart, läkemedlens bindningsmekanismer var olika (figur 2). Bindningsställena som riktas mot ergotamin är lika i många proteiner, vilket förklarar kemikaliens oselektivitet. Ritanserin, å andra sidan, interagerar med receptorn annorlunda och verkar bara på några av dess fragment som är unika för en liten grupp av proteiner. Vi introducerar flera mutationer som förändrar dessa fragment i 5HT2c-receptorgenen, forskarna märkte att interaktionen med ritanserin blev mindre effektiv – det faktum som bekräftade att dessa proteinområden är de som är ansvariga för kemikaliens selektivitet.
Petr Popov, en forskare vid MIPT:s Laboratory of Structural Biology of G-proteinkopplade receptorer, säger, "Den största utmaningen med att identifiera receptorstrukturer var att få en stabil, genetiskt modifierad konstruktion som skulle vara lämplig för kristallisering och som vi kunde arbeta med och studera. Genom att använda den bioinformatiska metoden och maskininlärningsmetoder, vi har identifierat stabiliserande punktmutationer för 5HT2c-receptorn både i dess aktiva och inaktiva tillstånd."
Således, analysen av de strukturella egenskaperna hos proteiner i komplex med läkemedel med varierande selektivitet visade sig vara effektiv. Det kan användas för att kontrollera uppsättningen av mål och därför både direkta och biverkningar av ett läkemedel under dess utveckling. Också, sådana läkemedel kommer att gynna många patienter tack vare förbättrade terapeutiska profiler som bekämpar en mängd olika sjukdomar och har färre biverkningar.