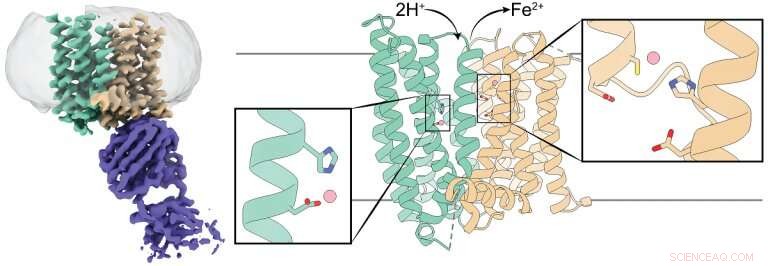
3D-struktur av ett ferroportin från däggdjur. Den vänstra panelen visar en kryo-EM-densitetskarta över ferroportin (grönt och brunt) i komplex med en antikropp (lila). De mittersta och högra panelerna visar en tecknad representation av ferroportin med dess N- och C-domäner färgade i blågrönt och brunt, respektive. Varje domän har en järnjonbindande plats markerad med en rektangellåda, och rester som koordinerar järnjonerna visas som pinnar. Kredit:Jiemin Shen/Zhou lab/ Naturkommunikation , 2020.
För mycket eller för lite järn i kroppen kan leda till sjukdomar, men organismer har utvecklat sätt att hålla järnnivåerna i balans. Ferroportin, den enda kända järnexportören som släpper ut järn i blodomloppet, är en avgörande komponent i järnbalanserande mekanismer.
Vi vill nå en bättre förståelse av järnreglering, ett team ledd av forskare vid Baylor College of Medicine analyserade 3D-strukturen hos ett ferroportin från däggdjur, avslöjar oväntade egenskaper och ett nytt verkningssätt som kan styra utvecklingen av innovativa terapeutiska strategier. Studien dyker upp i Naturkommunikation .
"Mer än 60 mutationer i ferroportingenen har associerats med mänskliga sjukdomar. Vissa av dessa mutationer gör ferroportin okänsligt för hepcidin, ett peptidhormon som syntetiseras i levern som bidrar till ferroportins reglering, " sa motsvarande författare Dr. Ming Zhou, Ruth McLean Bowman Bowers professor i biokemi och molekylärbiologi. Zhou är också medlem i Dan L Duncan Comprehensive Cancer Center i Baylor.
Ferroportin och hepcidin samordnar sina aktiviteter för att hålla järn i kroppen i rätt balans. Ferroportin exporterar järn till blodet, och hepcidin kontrollerar att exporten inte överstiger behoven. När det inte svarar på hepcidin, ferroportin förblir aktivt. Följaktligen, kroppen är belastad med järn, ett tillstånd som kallas järnöverbelastningssjukdom.
"Vi skulle vilja bättre förstå processen för reglering av järntransport genom att titta på strukturen av ferroportin, " sa medförfattaren Dr. Yaping Pan, biträdande professor i biokemi och molekylärbiologi vid Baylor. "Varken strukturen av ferroportin eller strukturen av ferroportin och hepcidin tillsammans har beskrivits. En närmare titt på dessa strukturer skulle ge nya insikter om hur ferroportin fungerar och hur hepcidin reglerar dess aktivitet, öppnar möjligheter för nya tillvägagångssätt för att behandla järnöverskottssjukdom."
Ett utmanande protein
Forskarna studerade ferroportin från primaten filippinska tarsier, vilket är mer än 90 procent likt humant ferroportin. Tidigare studier som tittade på bakteriellt ferroportin och andra järntransportörer hade visat att dessa proteiner bara har ett järnbindningsställe, de bär en järngrupp åt gången.
"Vi började vår studie med antagandet att tarsier ferroportin också hade ett järnbindningsställe och var ganska förbryllade över resultaten av våra experiment, " sa medförfattaren Jiemin Shen, doktorand i kvantitativ och beräkningsbiovetenskap i Zhou-labbet.
Till exempel, teamet genomförde experiment för att bestämma hur förändring av järnbindningsstället skulle påverka 3D-strukturen av ferroportin. De blev fascinerade när de upptäckte att en förändring av webbplatsen inte verkade ha någon större effekt, motsatsen till vad de förväntade sig. När vi väl avslöjade ferroportins struktur med kryo-elektronmikroskopi, vi insåg att det har två järnbindningsställen. Detta var en överraskning som förklarade uppgifterna som hade förbryllat oss."
"Vi ändrade bara en plats och det verkar som att den andra platsen fortfarande var i arbete med att binda järn, så vi såg inte mycket förändring på ferroportins struktur, " sa Shen.
En andra riktigt spännande upptäckt var att tarsier ferroportins verkningssätt skiljer sig från de som rapporterats för andra järntransportörer, " sa Zhou.
"Järnjonferroportinexporten bär två positiva elektriska laddningar. Vi fann att när ferroportin exporterar järnjoner, protoner, som har en positiv laddning, transporteras in i cellen, balansera avgifterna och underlätta ytterligare järnexport, " sa Pan.
"Vi använder dessa nya strukturella och funktionella fynd för att identifiera små molekylkandidater som kan reglera ferroportin. Vi studerar också mänskligt ferroportin, Zhou sa. "Detta projekt har god potential för att översätta resultaten till sängkanten."