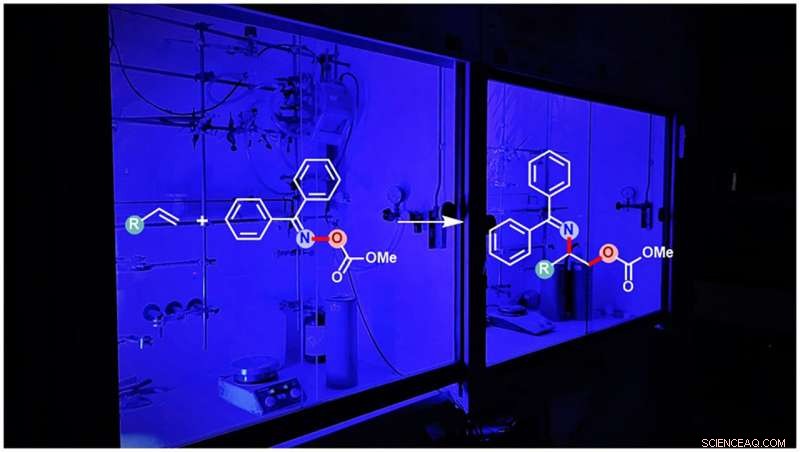
Fotosensibiliserad syntes av skyddade aminoalkoholer. Kredit:WWU - Glorius Group
Oavsett om det är i betablockerare för att behandla högt blodtryck eller i naturliga produkter, så kallade vicinala aminoalkoholer är högkvalitativa organiska föreningar som finns i många vardagliga föremål. Dock, deras produktion är svår, och under lång tid, kemister har försökt utveckla effektiva metoder för att syntetisera dem. I deras senaste studie publicerad i tidskriften Naturkatalys , forskare under ledning av prof. dr. Frank Glorius vid universitetet i Münster har hittat en lösning för framställning av en speciell variant av aminoalkoholer. "Den nya metoden hjälper till att studera ämnets egenskaper och att hitta tillämpningar för dessa nya föreningar i framtiden, " betonar Glorius från Organic Chemistry Institute vid Münster University.
Vicinala aminoalkoholer kan förekomma i två olika varianter - kallade regioisomerer - där de funktionella amin- och alkoholgrupperna byter positioner. Även om de alltså är väldigt lika, de har ofta olika biokemiska egenskaper. Installation av både amin- och alkoholgrupper i ett steg utgör en stor utmaning. Upptäckten av den asymmetriska aminohydroxideringsreaktionen med vilken en av regioisomererna kan framställas resulterade till och med i ett Nobelpris till kemisten Barry Sharpless 2001. den andra regioisomeren kan inte syntetiseras med en liknande metod och förblev ett långvarigt problem - fram till nu. Med hjälp av kemisternas nya fotoinitierade reaktionsmetod, syntesen av den andra regioisomeren har nu också blivit effektivt möjlig.
Oaktiverade alkener som innehåller en kol-kol dubbelbindning är kända som råmaterialkemikalier för reaktionsprocesser på grund av deras goda tillgänglighet. I allmänhet, installationen av både amin- och alkoholgrupper i ett steg via denna kol-kol-dubbelbindning av oaktiverad alken initieras alltid av amingruppen, följt av tillägget av alkoholgruppen. Som ett resultat, en speciell regioisomer av den vicinala aminoalkoholen bildas alltid. Nu har forskarna identifierat en speciell klass av aminliknande föreningar som är reaktiva men ändå stabila nog att först tillåta tillägg av alkoholgruppen till kol-kol-dubbelbindningen, följt av tillsats av amingruppen för att generera den tidigare otillgängliga motsatta regioisomeren av de vicinala aminoalkoholerna.
"Som växter använder klorofyll för att omvandla ljus till energi, vi använder vad som kallas en fotokatalysator, " förklarar Dr. Tuhin Patra, första författare till denna studie. "Denna art kan absorbera ljuset från blå lysdioder och överföra sin energi till en molekyl som är direkt involverad i reaktionen. Detta frigör samtidigt amin- och alkoholgrupperna." Denna process, där molekylerna överför elektroner till varandra, kallas energiöverföring, förklarar vetenskapsmannen.
Fascinerande nog, den nya metoden genererar den minst tillgängliga regioisomeren av de vicinala aminoalkoholerna på ett sådant sätt att både alkohol- och amingrupperna skyddas från ytterligare reaktioner. Beroende på användarens behov, en av de två alkohol- eller amingrupperna kan nu återaktiveras utan att påverka den andra. Dock, även båda grupperna kan aktiveras att reagera ytterligare samtidigt, om det är nödvändigt för syntesen av ytterligare krav. "Tidigare konstruktioner installerar vanligtvis bara en grupp åt gången i en komplex övergripande process i flera steg. Vår design tillåter inte bara installation av två olika grupper i ett steg med önskat skydd, men genererar också på ett tillförlitligt sätt den minst tillgängliga regioisomeren, erbjuder chansen att undersöka framtida tillämpningar av denna förening, avslutar Glorius.