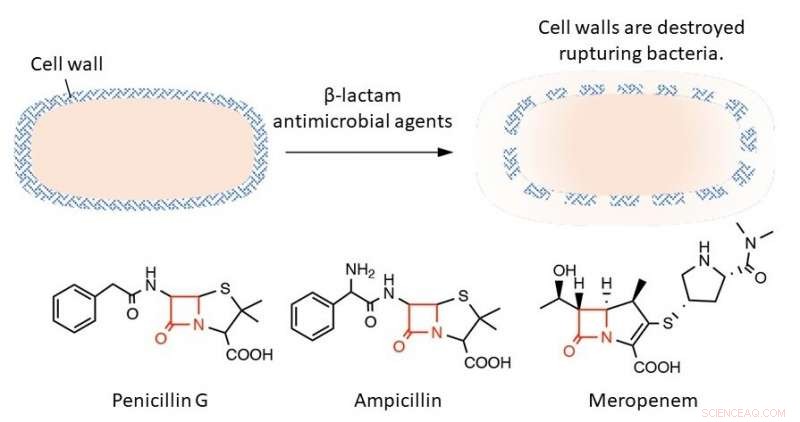
Överst:β-laktam antimikrobiella medel spränger bakterier genom att förstöra deras cellväggar. Nederst:Den röda texten i strukturformeln representerar β-laktamringen, som är avgörande för bakteriedödande verkan. Kredit:Professor Tomohiro Sawa
Ett gemensamt forskningsprojekt baserat på Kumamoto University, Japan har utvecklat en ny, mycket känslig analysmetod som kan detektera nedbrutna β-laktam antibakteriella medel som används vid behandling av bakterieinfektioner. Med denna metod, forskare fann att reaktiva svavelarter som produceras av bakterier bryter ned och inaktiverar β-laktamantibiotika.
Bakterier skiljer sig från djurceller genom att deras yttre skikt är täckt med en stel struktur som kallas cellvägg. β-laktam antimikrobiella medel stör processerna som bildar cellväggen. Detta resulterar i att bakterier inte längre kan stå emot sitt eget inre tryck så att de spricker och dör. β-laktam antimikrobiella medel är mycket potenta eftersom de selektivt hämmar bakteriell cellväggsyntes och har få biverkningar på värdar såsom människor. Dessa antimikrobiella medel har en gemensam struktur som kallas β-laktamringen som är väsentlig för att hämma cellväggsutvecklingen. Om denna ring är försämrad, den antimikrobiella effekten försvinner.
Tidigare studier har rapporterat att svavelväte (H2S), som bakterier producerar under svavelmetabolism, minskar deras känslighet för antimikrobiella medel som leder till resistens. Dock, den detaljerade mekanismen som orsakar detta är ännu inte förstått. Forskare vid Kumamoto University har tidigare visat att molekylen cysteinpersulfid, en kombination av H2S och aminosyran cystein, har en extremt potent antioxidanteffekt som inte finns i enbart H2S eller cystein.

Svavelväte (H2S) är fäst till tiolgruppen (-SH) i cystein. Kredit:Professor Tomohiro Sawa
I den här studien, forskare undersökte hur denna reaktiva svavelart är involverad i förvärvet av resistens mot β-laktamantibiotika. De upptäckte att β-laktamantibiotika som penicillin G, ampicillin, och meropenem (karbapenemantibiotika) förlorar snabbt bakteriedödande aktivitet när de utsätts för cysteinpersulfid men inte med vätesulfid. En detaljerad studie av reaktionen mellan β-laktamantimikrobiella medel och cysteinpersulfid visade att β-laktamringen, som är avgörande för bakteriedödande verkan, sönderdelas och en svavelatom sätts in i en del av ringen och skapar karbotiosyra. Produktionen av karbotiosyra från ett β-laktam antimikrobiellt medel verkar vara en ny nedbrytningsmetabolit.
Forskare utvecklade alltså en mycket känslig analysmetod för att detektera och kvantifiera karbotiosyra med hjälp av masspektrometri, och analyserade sedan karbotioinsyraproduktion från bakterier som exponerades för β-laktamantimikrobiella medel. De fann att bakterier kan absorbera antimikrobiella medel och använda cysteinpersulfid för att bryta ned medlen till karbotiosyra som sedan släpps ut. Detta tros vara en tidigare obeskriven inaktiverings- och nedbrytningsmekanism av β-laktamantimikrobiella medel till karbotiosyra av cysteinpersulfid.
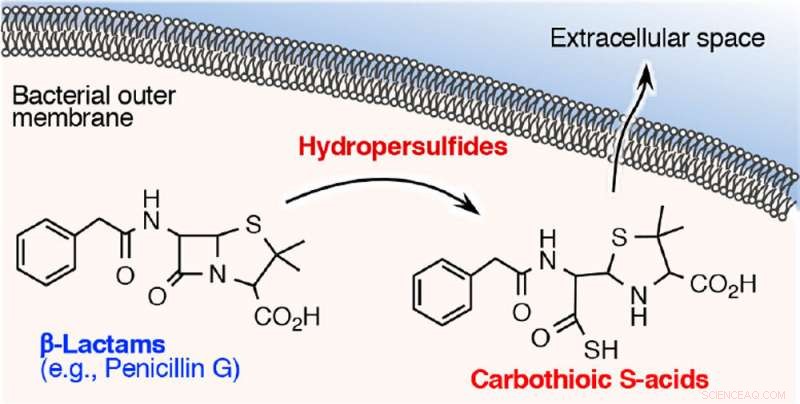
β-laktam antimikrobiella medel inuti bakterierna bryts ned till karbotiosyra och släpps sedan ut. Kredit:Professor Tomohiro Sawa
"Vår nyutvecklade analysmetod gör det möjligt att kvantifiera mängden karbotiosyra som släpps ut från bakterier med hög känslighet, sa professor Tomohiro Sawa, som ledde studien. "Vi tror att det kommer att vara möjligt att screena för föreningar som hämmar bakteriell syntes av cysteinpersulfid genom att använda karbotiosyra som biomarkör. En sådan cysteinpersulfidsynteshämmare i kombination med β-laktamantibiotika förväntas hämma antibiotikanedbrytning och resultera i framgångsrika behandlingar med en lägre koncentration av β-laktamantibiotika. Detta bör också bidra till att minska uppkomsten av nya resistenta bakterier."
Denna forskning publicerades online i ACS kemisk biologi den 30 mars 2021.