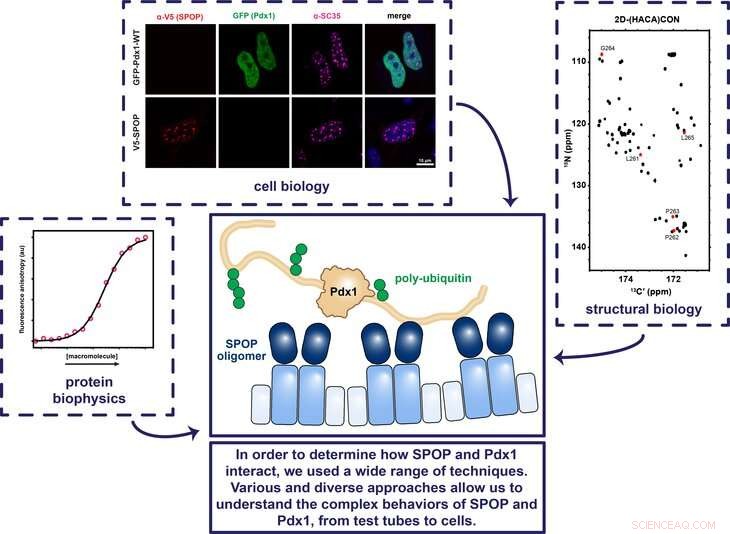
Penn State -forskare använde en mängd olika tekniker angående cellbiologi, strukturbiologi, och proteinbiofysik för att avgöra hur proteinerna SPOP och Pdx1 fungerar tillsammans för att säkerställa att genen som kodar för insulin slås på och av vid rätt tidpunkt. Upphovsman:Showalter Lab, Penn State
Vissa proteiner i kroppen ser till att gener slås på och av vid rätt tidpunkter. Till exempel, transkriptionsfaktorproteinet Pdx1 (pankreas och duodenal homeobox 1) tänder på genen som kodar för insulin, och proteinet SPOP (speciellt typ POZ-protein) binder i sin tur till Pdx1 så att kroppen inte producerar för mycket insulin. Men det är oklart hur SPOP binder till Pdx1. Att förstå var SPOP binder kan hjälpa forskare att förutsäga vad som föranleder individer att utveckla diabetes och klargöra hur SPOP reglerar andra viktiga proteiner. I en färsk studie, ett team av forskare från Penn State och St. Jude Children's Research Hospital avbildade proteinerna och bestämde hur denna viktiga interaktion uppstår.
Ett papper som beskriver samspelet publicerades nyligen i Journal of Biological Chemistry . Vi pratade med två av författarna till tidningen, Scott Showalter, professor i kemi och biokemi och molekylärbiologi, och Emery Usher, doktorand i biokemi, Programmet för mikrobiologi och molekylärbiologi (BMMB), om detta arbete.
F:Varför är Pdx1 viktigt för människokroppen, och hur stöder SPOP dess funktion?
Showalter:Pdx1 är en transkriptionsfaktor, som är ett protein som binder till DNA:t i ditt genom och styr om gener i närheten kommer att slås på eller av. I människor, Pdx1 finns främst i bukspottkörteln, där den slår på genen som kodar för proteininsulinet när mer av det behövs. När tillräckligt med insulin lagras för framtiden, SPOP binder till Pdx1 och gör att det förstörs av cellulära proteinåtervinningsmaskiner, vilket stänger av insulinproduktionen.
Usher:I slutändan, Pdx1 och SPOP arbetar tillsammans för att upprätthålla glukoshemostas; det är, den noggranna balansen mellan glukosnivåer i cellerna och i blodet. I synnerhet, SPOP utför en liknande reglerande roll för dussintals andra proteiner i massor av olika typer av celler, som alla är avgörande för lämplig cellfunktion.
F:Vad var din motivation för denna studie?
Showalter:Även om vi visste att Pdx1 och SPOP arbetar tillsammans för att reglera den insulin-kodande genen, före denna studie var detaljerna i denna interaktion oklara. Det var känt från annat arbete att SPOP stänger av proteiner genom att fästa en molekylär signal till dem som riktar sig mot dessa proteiner för destruktion, men Pdx1 ser inte ut som andra proteiner som SPOP reglerar. Nästan alla proteiner som är kända för att regleras av SPOP har flera igenkänningssekvenser, eller sekvenser av aminosyror som fungerar som ett lösenord. Dock, Pdx1 innehåller inte någon av de sekvenser som SPOP var känt att binda till. Mitt laboratorium har investerat mycket arbete under det senaste decenniet för att utveckla tekniker som kan användas för att karakterisera interaktioner som de som vi visste måste finnas mellan Pdx1 och SPOP. I den här studien, vi bestämde oss för var SPOP binder till Pdx1 och hur den vet att den har hittat rätt plats (er).
Usher:SPOP kan faktiskt känna igen mer än en av dessa aminosyralösenordssekvenser och kan därmed rikta in sig på många partners, så det är svårt att ta fram en omfattande lista över aminosyrasekvenserna som SPOP letar efter. Att undersöka interaktionen mellan Pdx1 och SPOP kan också ge insikt i andra proteiner som SPOP kan binda till.
F:Vilka var de viktigaste resultaten av denna studie?
Showalter:Vi var mycket glada över att upptäcka att det inte bara finns en SPOP -bindningsplats på Pdx1, men två. Det är känt att SPOP generellt binder flera platser i proteinerna som det kontrollerar, så detta resultat var mycket tillfredsställande eftersom det gör att Pdx1 -regleringen överensstämmer med gemenskapens mer allmänna förståelse för hur SPOP fungerar. Efter att vi hittat den andra bindningsplatsen, vi använde röntgenkristallografi för att avbilda komplexet som bildas när SPOP är bunden till Pdx1 vid dessa nyupptäckta bindningsställen. Denna struktur avslöjade att även om en ovanlig sekvens av aminosyror i Pdx1 var involverad i SPOP -bindning, de geometriska och kemiska detaljerna var faktiskt väldigt lika tidigare bestämda strukturer. Våra resultat tyder på att den tidigare definitionen av en SPOP -bindningsplats var för smal.
Usher:Vi har nu en bättre förståelse för de kemiska regler som definierar om en sekvens är en bra kandidat att binda eller inte. Vår struktur föreslår också en trolig mekanism för att störa Pdx1 -bindning av SPOP när denna interaktion är oönskad - till exempel när Pdx1 behövs för att producera mer insulin.
F:Varför är dessa fynd viktiga?
Showalter:Det är viktigt att förstå de molekylära detaljerna i biologiska processer som glukosberoende insulinproduktion och hur de regleras eftersom det är de avgörande faktorerna mellan normal hälsa och sjukdom. Att förstå sekvenserna som SPOP binder till hjälper oss att förutsäga varför vissa genetiska variationer kan predisponera individer och familjer som bär dem för att utveckla diabetes. Liknande, genom att klargöra de regler som SPOP använder för att identifiera de proteiner det ska binda till och reglera, vi kan bättre förutsäga andra proteiner som den reglerar. Vi kan också kunna förutsäga hur naturligt förekommande variationer i deras aminosyrasekvenser kan störa normal SPOP -bindning, som leder till dåliga hälsoutfall.
Usher:SPOP är också känd för sin roll i vissa cancerformer, inklusive prostatacancer och endometriecancer. Även om det inte ligger inom ramen för vårt nuvarande arbete, bättre att definiera hur SPOP väljer bindande partner kommer sannolikt också att påverka framtida forskning på detta område.