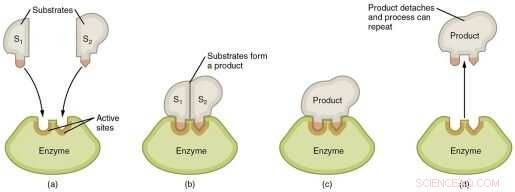
Grafisk representation av stegen i en enzymatisk reaktion. Kredit:Wikimedia Commons
De enzymer som finns i levande organismer har en imponerande katalytisk kraft. Tack vare enzymer sker de kemiska reaktionerna som upprätthåller liv miljontals gånger snabbare än de skulle inträffa utan dem. Enzymer påskyndar reaktioner genom att hjälpa till att sänka den aktiveringsenergi som behövs för att starta dem, men i mer än 70 år har hur enzymer uppnår detta varit föremål för intensiv debatt.
Dr Tor Savidge, professor i patologi och immunologi vid Baylor College of Medicine och Texas Children's Microbiome Center, och hans kollegor ändrar sättet att se på detta gamla argument. I deras arbete publicerat i Chemical Science , undersökte de likheterna och skillnaderna mellan de två mekanismerna som för närvarande diskuteras genom att karakterisera katalytiska reaktioner på en detaljerad molekylär nivå.
"För närvarande föreslås två stora olika reaktionsmekanismer för att förklara enzymatisk katalytisk kraft," sa Savidge. "Den ena föreslår att enzymer sänker reaktionens aktiveringsenergi via stabilisering av övergångstillstånd (TS) och den andra att de gör det genom att destabilisera grundtillståndet (GS) hos enzymer. Den nuvarande tanken är att dessa mekanismer utesluter varandra."
Förstaförfattaren Dr. Deliang Chen vid Gannan Normal University i Kina och hans kollegor tog ett teoretiskt tillvägagångssätt och tog hänsyn till tidigare rön från Savidge-labbet som visar att de icke-kovalenta interaktionerna mellan substrat och enzymer med vatten är viktiga när det gäller mekanismen för den enzymatiska reaktioner.
"I en biologisk miljö måste du tänka på vattnet - att det kommer att störa de mycket komplexa atomära interaktionerna som sker i enzymets aktiva plats. Vi måste överväga dem alla för att förstå exakt var du behöver ha elektrostatiska interaktioner som är kommer att gynna den enzymatiska processen," sa Savidge. "När du tar hänsyn till det kan du förstå hur dessa mekanismer fungerar."
Deras analyser fick teamet att föreslå något nytt:att TS och GS trots allt inte är så olika. De använder en liknande atommekanism för att öka den enzymatiska reaktionen framåt. Mekanismen involverar vatten för att förändra laddningen av viktiga rester inom det katalytiska stället på ett sätt som gynnar bildandet av ett energimässigt gynnsamt tillstånd som driver den enzymatiska reaktionen att inträffa.
"Den viktiga, nya punkten här är inte hur detta uppnås utan när det uppnås," sa Savidge. "Vi har visat att vid stabilisering av övergångstillstånd bildas laddningarna som driver reaktionen framåt innan substratet går in i det aktiva stället. Medan det är i destabiliseringsgrundtillståndet inträffar detta också, men efter att substratet kommer in i det aktiva stället."
Forskarna föreslog också att den gemensamma mekanismen mellan TS och GS är universell; det kan appliceras på många enzymatiska reaktioner.
Deras resultat har viktiga konsekvenser, inte bara för att hjälpa forskare att bättre förstå enzymers katalytiska kraft, utan också för praktiska läkemedelsdesignapplikationer.
"Vi använder våra resultat för att djupare utforska mikrobiell enzymatisk katalys i olika miljöer och för att designa artificiella enzymer," sa Savidge.
Yibao Li, Xun Li, Xiaolin Fan vid Gannan Normal University och Xuechuan Hong vid Wuhan University School of Pharmaceutical Sciences bidrog också till detta arbete. + Utforska vidare