Ringformade kemiska strukturer som kallas mättade heterocykler finns i de flesta FDA-godkända läkemedel men är ofta svåra att skapa. Scripps Forskningskemister har just utvecklat en förvånansvärt enkel metod för att göra många av dessa eftertraktade föreningar från billiga startkemikalier.
Den nya metoden, beskriven i en artikel som publiceras den 11 april 2024, i Nature Synthesis , gör det möjligt för kemister att göra mättade heterocykler från relativt enkla, kedjeliknande aminföreningar.
Forskarna visade kraften i deras nya metod genom att använda den för att utföra en effektiv syntes av stemoamid, en komplex växthärledd förening som finns i traditionella mediciner.
"Dessa nya reaktioner borde göra det enklare än någonsin att konstruera mättade heterocykler med ringstorlekar och strukturer som är relevanta för läkemedelsutveckling", säger studie senior författare Jin-Quan Yu, Ph.D., Frank och Bertha Hupp professor i kemi och Bristol Myers Squibb begåvad ordförande i kemi vid Scripps Research.
Den första författaren var Sam Chan, Ph.D., en postdoktor vid Yu-labbet under studien.
Mättade heterocykler är cykliska organiska föreningar vars ryggradsstruktur innehåller minst en icke-kolatom. I heterocykliska läkemedelsföreningar är icke-kolatomen vanligtvis en kväveatom, som ofta spelar en avgörande roll för att bestämma föreningens kemiska egenskaper och terapeutiska effektivitet. Emellertid är nuvarande metoder för att tillverka dessa mycket värdefulla föreningar ganska begränsade. Även när de kan användas tenderar de att vara besvärliga eller kräva relativt dyra och komplexa utgångsmaterial.
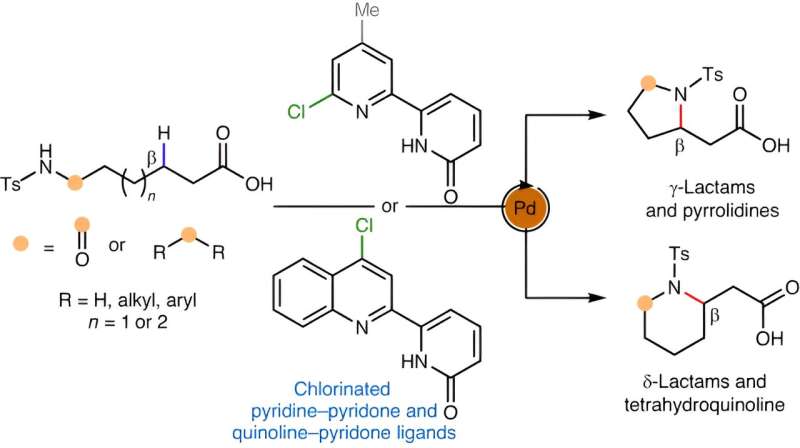
"Det bekvämaste sättet att smida en sådan ring skulle vara att ta en lättillgänglig alifatisk aminförening, som innehåller kväve, och sy fast det kvävet på en annan del av dess kolryggrad, vilket i huvudsak viker molekylen på sig själv", säger Yu.
Detta skulle innebära att en väteatom avlägsnas för att tillåta den nya kol-kvävebindningen att bildas - vilket gör det till en typ av "CH-aktiveringsreaktion", länge Yu-labbets specialitet. Ingen sådan CH-reaktion för att bilda cykliska aminer har funnits - inte en praktisk, i alla fall. För den nya studien gav Yu och hans team sig i kast med att uppfinna en.
Metoden de slutligen utarbetade inkluderade en palladiumkatalysator för att bryta CH-bindningen. Det involverade också en uppsättning molekyler som kallas klorerade pyridin-pyridoner som fungerar som så kallade ligander med rätt geometri för att främja bildningen av nya C-N-bindningar.
Kemisterna visade upp sitt nya tillvägagångssätt genom att enkelt tillverka dussintals cykliska aminer och relaterade strukturer, inklusive γ- och δ-laktamer, pyrrolidiner och tetrahydrokinoliner – som alla skulle vara av intresse för farmaceutiska kemister.
I en sista uppsving visade de upp användbarheten av deras metod med en syntes - nästan från början med en mycket enkel aminförening - av den växthärledda cykliska amidstemoamiden, som har setts som en potentiell utgångspunkt för nya antiinflammatoriska medel. droger.
Yu och hans team arbetar för närvarande med att utöka sitt nya tillvägagångssätt för att göra andra typer av mättad heterocykel.
"Palladiumkatalyserad metylen C(sp 3 )–H-laktamisering och cykloaminering som möjliggörs av klorerade pyridin-pyridonligander" var medförfattare av Hau Sun Sam Chan, Yilin Lu och Jin-Quan Yu, alla från Scripps Research.
Mer information: Hau Sun Sam Chan et al, Palladium-katalyserad metylen C(sp 3 )–H-laktamisering och cykloaminering möjliggörs av klorerade pyridin–pyridonligander, Nature Synthesis (2024). DOI:10.1038/s44160-024-00517-5
Journalinformation: Natursyntes
Tillhandahålls av The Scripps Research Institute