Peptider är biomolekyler som bildas när två eller flera aminosyror som utför nyckelfunktioner i den mänskliga organismen, såsom hormoner, signalsubstanser, smärtstillande medel och antibiotika, binder samman. Av denna anledning är de mycket studerade och används av till exempel läkemedelsindustrin.
En studie utförd av forskare vid institutionen för biofysik vid Federal University of São Paulos Medical School (EPM-UNIFESP) i Brasilien identifierade betydande förändringar i de fysikalisk-kemiska egenskaperna hos peptider under en spontan process av kemisk förändring som kallas pyroglutamination.
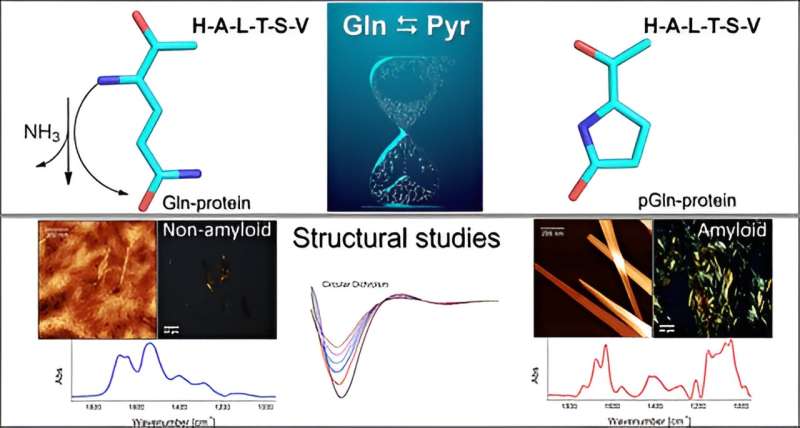
Pyroglutaminering är en modifiering som är resultatet av spontan omvandling av glutamin till pyroglutaminsyra, med en betydande inverkan på peptidernas fysikaliska och kemiska egenskaper. Det är en välkänd men ofta förbisedd del av peptidsyntesen och utforskas sällan inom proteomik.
Forskarna som genomförde studien betonar att det kan ske snabbt och accelererar när temperaturen stiger, vilket understryker behovet av försiktighet under laboratorieexperiment för att förhindra glutamincyklisering. Det är särskilt viktigt under förhållanden som efterliknar fysiologiska miljöer där temperaturen ligger inom intervallet 37°C, den normala temperaturen för en frisk mänsklig organism.
Upptäckten har implikationer för laboratorieforskning och öppnar nya möjligheter för studier av neurodegenerativa sjukdomar som Alzheimers och Parkinsons, eftersom molekylen efter kemisk modifiering får en amyloidstruktur som gynnar aggregering av molekyler och bildar plack som de som tros orsaka sjukdomarna i fråga.
En artikel om studien publiceras i Biochemistry .
Gruppen genomförde in vitro-experiment för att undersöka mekanismen varigenom aminosyran glutamin (Gln) blir pyroglutaminsyra (Pyr) i närvaro av en peptid- eller proteinsekvens vid den N-terminala extremiteten. Denna process sker genom deamidering, en reaktion som eliminerar ammoniak (NH3 ). Pyr (även kallat pyroglutamat) är en cyklisk aminosyra som bildas som ett resultat av uttorkning av glutamat. Alla proteiner består av flera aminosyror sammanfogade av peptidbindningar, med variationer i antal och sekvens av aminosyror.
"Resultatet kan fungera som en modell för många forskare som arbetar med peptider. Vi kom fram till två nyckelfynd. Vi återvände till ett gammalt ämne, som är hur glutamin bryts ner till pyroglutaminsyra, men vi införde en varning om vikten av att analysera Den andra punkten var att efter omvandling av peptiden förändras dess egenskaper och den tenderar att fastna på membranen."
"Närvaron av pyroglutaminsyra gynnar bildningen av amyloidogena aggregat, liknande de konglomerat som vanligtvis finns i fall av neurodegenerativ sjukdom. Dessa amyloidplack bildas i hjärnan och avbryter flödet av neuroner", säger Clovis Ryuichi Nakaie, sista författare till boken. artikel.
Modellen peptidsekvens (QHALTSV-NH2) som användes i studien har sitt ursprung i Ph.D. forskning av Mariana Machado Leiva Ferreira, första författare till artikeln, medan hon letade efter en syntes av cirka två dussin peptider som finns i sekvenserna av fem G-proteinkopplade receptorer (GPCR) som varierade i storlek upp till cirka 20 aminosyror. GPCR:er fångar ett brett spektrum av extracellulära signaler (från fotoner till joner, proteiner, signalsubstanser och hormoner) och aktiverar signalvägar inuti celler.
En av de peptider som syntetiserats av Ferreira stack ut för sitt låga utbyte och var den enda med glutamin vid aminextremiteten. "Efter det första försöket med syntes med mycket lågt utbyte varierade vi flera parametrar för att öka produktionen av peptiden, inklusive förändringar av den syntetiska delen och i reningsprocessen, men tyvärr försämrades den alltid delvis", sa hon.
När gruppen testade lösningar som ofta används i proteomexperiment, fann de att glutaminomvandling till pyroglutaminsyra inträffade i dem alla som en funktion av tiden, i enlighet med typisk första ordningens kinetik, där omvandlingshastigheten var proportionell mot tiden det togs. av reaktionen. De bestämde sig då för att inte agitera lösningen så att samtalsfrekvensen kunde utläsas. Till exempel uppskattade de att efter fem timmar troligen omvandlas minst 10 % av glutaminet till pyroglutaminsyra.
En mindre strukturell förändring som utlöstes när den naturliga peptiden pyroglutaminerades vid den N-terminala extremiteten var tillräcklig för att ändra molekylens fysikalisk-kemiska beteende.
"Eftersom den är cyklisk och har en positiv laddning mindre, borde peptiden Pyr vara mer hydrofob än den naturliga molekylen, och vi förväntade oss därför att analogen skulle interagera med membranmimetiska system. Vad vi inte förutsåg var att analogen skulle medföra bildning av amyloidstrukturer som de som ses i neurodegenerativa sjukdomar Vi studerade inte någon av dessa, men våra resultat pekar i den riktningen, säger Emerson Rodrigo da Silva, näst sista författare till artikeln, till Agência FAPESP. Silva och Nakaie är motsvarande författare.
Nakaie betonade vikten av post-translationella förändringar i organismen som involverar polypeptidkedjan. De spelar en roll i den funktionella mångfalden av proteiner och möjliggör anpassning av en sekvens av aminosyror som kodas av en gen för att utföra olika regulatoriska funktioner.
"I det här sammanhanget kommer tiden som en faktor alltid att korrelera med förekomsten av förändringar, oavsett deras hastighet eller var de befinner sig i vår organism. Detta påminner om idén med den biologiska klockan och är anledningen till att vi föreslog att sätta ett timglas på omslaget av tidskriften för att symbolisera den spontana omvandlingen av Gln till Pyr," sa Nakaie.
Han har varit professor vid EPM-UNIFESP i 45 år och betonade det banbrytande arbete som gjorts av gruppen vid institutionen för biofysik. I synnerhet, noterade han, introducerade de syntesen och biokemin av peptider och aminosyraderivat till Brasilien.
"Våra resultat kommer utan tvekan att bana väg för ytterligare studier. Efter att ha avslutat det arbete som Mariana Ferreiras doktorandforskning var en del av, vill vi också fortsätta med denna forskningslinje", sa han.
Mer information: Mariana M. L. Ferreira et al, Pyroglutamination-inducerade förändringar i de fysikalisk-kemiska egenskaperna hos en CXCR4-kemokinpeptid:kinetisk och strukturell analys, Biokemi (2023). DOI:10.1021/acs.biochem.3c00124
Journalinformation: Biokemi
Tillhandahålls av FAPESP