En ny högupplöst metod utvecklad av ett internationellt team av forskare inklusive Robert Tampé och Ralph Wieneke från Goethe University Frankfurt tillåter nu för första gången exakt identifiering och kvantifiering av interaktioner mellan en receptor med två ligander samtidigt. Kredit:GU
Signaleringsprocesser i organismer styrs av specifika extracellulära och intracellulära interaktioner och involverar hundratals olika funktionellt mycket mångsidiga receptorer som finns i cellmembran. För forskare som vill förstå signaleringsprocesser blir situationen mer komplex av att receptorerna inte bara är ojämnt fördelade och ofta kan binda mer än en ligand utan också genom att samma typ av receptor kan binda en ligand starkt, svagt eller inte alla. Nya metoder som tillåter exakta kvantifieringar av sådana komplexa interaktioner är akuta nödvändiga.
En ny högupplöst metod utvecklad av ett internationellt team av forskare inklusive Robert Tampé och Ralph Wieneke från Goethe University Frankfurt tillåter nu för första gången exakt identifiering och kvantifiering av interaktioner mellan en receptor med två ligander samtidigt. Den nya metoden har publicerats i den senaste upplagan av tidskriften Naturkommunikation .
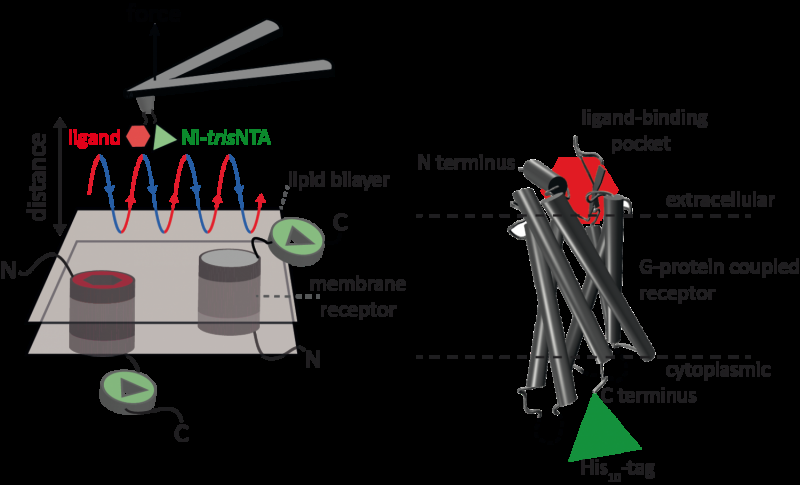
Atomic force microscopy (AFM) är en kraftfull teknik för nanoskala karakterisering av ytor. Den använder sig av en cantilever med en extremt fin spets. Kraft-distanskurvabaserad atomkraftmikroskopi (FD-baserad AFM) kombinerar högupplöst bildbehandling och enmolekylkraftspektroskopi. I studier med biologiska prover, AFM-spetsen närmar sig och dras tillbaka från provet för varje pixel. FD-baserade AFM-metoder använder olika beläggningar av AFM-spetsen som en verktygslåda och sådana metoder har gjort imponerande framsteg de senaste åren. För detektion av specifika bindningsställen kräver FD-baserad AFM att en ligand kopplas till AFM-spetsen. Medan de konturerar proteinkomplex i ett membran kan sådana funktionaliserade AFM-spetsar sedan mäta interaktionerna mellan den bundna liganden och proteinet. Det hade inte varit möjligt att avbilda enstaka membranreceptorer och samtidigt detektera deras interaktioner med mer än en ligand, men den nya metoden har övervunnit detta hinder.
Som bevis på principen använde forskarna den humana proteasaktiverade receptorn 1 (PAR1), en av den stora familjen av G-proteinkopplade membranreceptorer. GPCR medierar de flesta cellulära svar på hormoner och neurotransmittorer, samt ansvara för visionen, doft och smak. GPCR kan samexistera i olika funktionella tillstånd i cellmembranet och kan binda olika ligander med olika styrka eller affinitet. GPCR PAR1 aktiveras av koagulationsproteaset trombin som utlöser signalkaskader för att initiera cellulära svar som hjälper till att orkestrera hemostas, trombos, inflammation och eventuellt även vävnadsreparation. Med hjälp av deras nya FD-baserade AFM-metod kunde human PAR1 i proteoliposomer avbildas samtidigt som extracellulära och intracellulära interaktioner av PAR1 med två ligander detekterades. Den utvecklade ytkemin och den nanoskopiska metoden är tillämpliga på en rad biologiska system in vitro och in vivo.