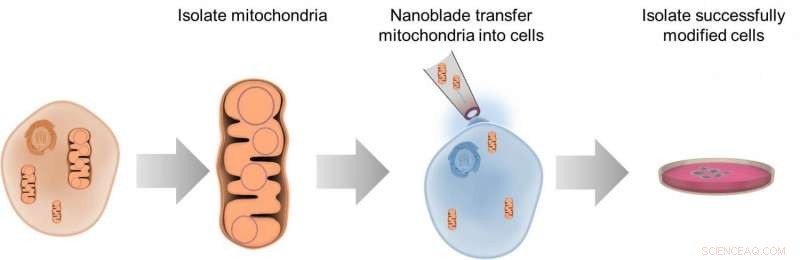
Detta diagram illustrerar processen att överföra mitokondrier mellan celler med hjälp av nanoblade-teknologin. Kredit:Alexander N. Patananan
För att studera vissa aspekter av celler, forskare behöver förmågan att ta ut inälvorna, manipulera dem, och sätt tillbaka dem. Alternativen för denna typ av arbete är begränsade, men forskare rapporterar 10 maj in Cellmetabolism beskriv ett "nanoblad" som kan skära genom en cells membran för att sätta in mitokondrier. Forskarna har tidigare använt denna teknik för att överföra andra material mellan celler och hoppas kunna kommersialisera nanobladet för bredare användning inom bioteknik.
"Som ett nytt verktyg för cellteknik, att verkligen konstruera celler för hälsoändamål och forskning, Jag tycker att detta är väldigt unikt, säger Mike Teitell, en patolog och bioingenjör vid University of California, Los Angeles (UCLA). "Vi har inte stött på något hittills, upp till några mikrometer i storlek, som vi inte kan leverera."
Teitell och Pei-Yu "Eric" Chiou, också en bioingenjör vid UCLA, kom först på idén om ett nanoblad för flera år sedan för att överföra en kärna från en cell till en annan. Dock, de grävde snart ner i skärningspunkten mellan stamcellsbiologi och energimetabolism, där tekniken kunde användas för att manipulera en cells mitokondrier. Studera effekterna av mutationer i mitokondriernas genom, som kan orsaka försvagande eller dödliga sjukdomar hos människor, är knepigt av flera anledningar.
"Det finns en flaskhals i fältet för att modifiera en cells mitokondriella DNA, " säger Teitell. "Så vi arbetar med en tvåstegsprocess:redigera mitokondriernas genom utanför en cell, och ta sedan de manipulerade mitokondrierna och sätt tillbaka dem i cellen. Vi jobbar fortfarande på det första steget, men vi har löst den andra ganska bra."
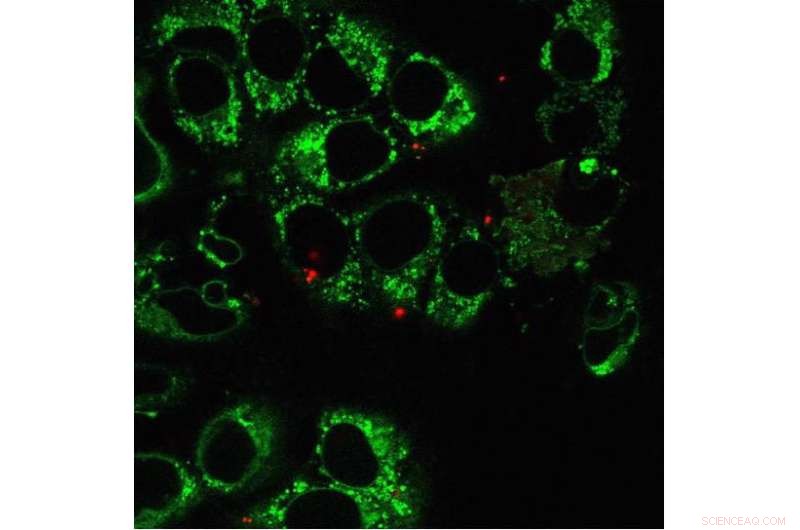
Den här bilden visar mänskliga osteosarkomceller och mitokondrier (grön), med ytterligare mitokondrier (röda) från mänskliga embryonala njurceller överförda via nanobladet. Mycket få rödmärkta mitokondrier levereras faktiskt av nanobladet till varje cell, jämfört med de redan existerande gröna mitokondrierna. Under några veckor, mitokondriella DNA i de rödmärkta mitokondrierna kommer att förstärkas massivt. Kredit:Ting-Hsiang Wu
Nanobladsapparaten består av ett mikroskop, laser, och titanbelagd mikropipett för att fungera som "bladet, " manövreras med en joystick-kontroll. När en laserpuls träffar titan, metallen värms upp, förångar de omgivande vattenlagren i odlingsmediet och bildar en bubbla bredvid en cell. Inom en mikrosekund bubblan expanderar, genererar en lokal kraft som punkterar cellmembranet och skapar en passage som är flera mikrometer lång än "lasten" - i det här fallet, mitokondrier – kan tryckas igenom. Cellen reparerar sedan snabbt membrandefekten.
Teitell, Chiou, och deras team använde nanobladet för att infoga taggade mitokondrier från mänskliga bröstcancerceller och embryonala njurceller i celler utan mitokondriellt DNA. När de sekvenserade kärn- och mitokondrie-DNA efteråt, forskarna såg att mitokondrierna framgångsrikt hade överförts och replikerats av 2% av cellerna, med en rad funktioner. Andra metoder för mitokondriell överföring är svåra att kontrollera, och när de har rapporterats att arbeta, framgångsfrekvenserna har bara varit 0,0001%-0,5% enligt forskarna.
"Framgången med mitokondrieöverföringen var mycket uppmuntrande, " säger Chiou. "Den mest spännande applikationen för nanobladen, till mig, är i studien av mitokondrier och infektionssjukdomar. Den här tekniken ger nya möjligheter för att främja dessa områden."
Teamets ambitioner går också långt utöver mitokondrier, och de har redan skalat upp nanobladsapparaten till en automatiserad version med hög genomströmning. "Vi vill skapa en plattform som är enkel att använda för alla och tillåta forskare att ta fram allt de kan tänka sig några mikron eller mindre som skulle vara till hjälp för deras forskning - oavsett om det är att infoga antikroppar, patogener, syntetiska material, eller något annat som vi inte har föreställt oss, " säger Teitell. "Det skulle vara väldigt coolt att låta folk göra något som de inte kan göra just nu."