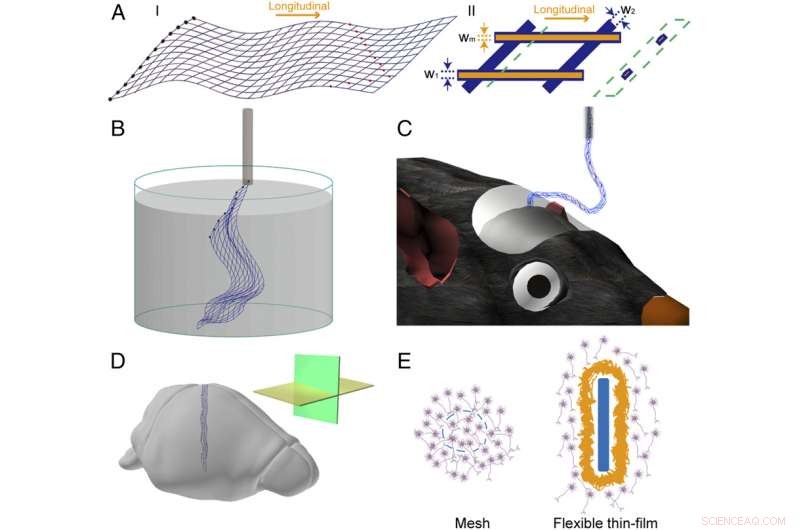
Figur 1. Schema för meshelektronik. ( A ) Schema över nätelektronikens struktur i 2D. ( jag ) Övergripande design av meshelektronikstruktur, där de blå linjerna markerar den övergripande nätstrukturen, de svarta fyllda cirklarna till vänster indikerar I/O-kuddar, och de röda fyllda cirklarna indikerar registreringselektroder. ( II ) En enda enhetscell av meshelektronik, där de orangea linjerna, som visas utan topppolymerskikt, markera metallförbindelserna och blå linjer motsvarar polymerpassiveringsskiktet; w 1 , w 2 , och W m ange bredden på den längsgående polymeren, tvärgående polymer, och metalllinjer, respektive. Schemat i den gröna streckade rutan framhäver tvärsnittsvyn, som visar den polymerinkapslade metallstrukturen, vid den position som indikeras av den gröna streckade linjen. ( B ) Schematisk bild av fristående nätelektronik flytande i vattenlösning och redo att laddas i en glasnål. ( C ) Schematisk nätelektronik injicerad i musens hjärna, med en del av nätet hängande mellan hjärnan och nålen. ( D ) Schematisk nätelektronik implanterad i hjärnvävnad med horisontella (gula plan) och sagittala (gröna) snittriktningar markerade i insättningen. ( E ) Schema över gränssnittet mellan meshelektronik och hjärnvävnaden ( Vänster , tvärsnittsvy) och den mellan flexibel tunnfilm och hjärnvävnaden ( Höger , tvärsnittsvy). Mesh-element och den flexibla tunnfilmen är markerade i blått, neuroner är i lila, och glialärr är i gult. Kredit:Zhou T, Hong G, Fu TM, Yang X, Schuhmann TG, Robert D. Viveros, RD, Lieber CM (2017) Sprutan-injicerbar mesh-elektronik integreras sömlöst med minimalt kroniskt immunsvar i hjärnan. Proc Natl Acad Sci USA 114(23):5894-5899.
(Phys.org)—Neuroproteser, neurala sonder och andra intraneurala vävnadsimplantat har erbjudit anmärkningsvärda fördelar för mottagare inom ett antal områden inom neurovetenskaplig forskning och biomedicinska tillämpningar, terapeutiska exempel är inte bara Alzheimers sjukdom, Parkinsons sjukdom, epilepsi, traumatisk hjärnskada, och andra neurologiskt/neurologiskt relaterade tillstånd, såväl som kognition, minne, och sensomotoriska störningar. Dock, nuvarande neurala implantat har flera nackdelar, inklusive neural vävnadsinflammation eller ärrbildning på grund av enhetens mikrorörelse, samt livslängd och det potentiella behovet av borttagning, och höga effektkrav. Att utforma elektriska sonder som sömlöst integreras i neural vävnad har därför varit ett eftertraktat mål. För detta ändamål, forskare vid Harvard University har rapporterat framgångsrik implantation av en neuromorf (det vill säga med en struktur som liknar hjärnvävnad) ultraflexibel neuralsond för öppen nätelektronik som levereras till specifika hjärnregioner via sprutinjektion (ett protokoll som de publicerade 2015 i Naturens nanoteknik ) 1 .
Sonden – som inte kräver strömförsörjning – registrerar direkt neurala spänningsförändringar genom att kunna samverka med alla regioner i hjärnan från nivån av en enda neuron genom kretsar och nätverk, där nätregistreringselektroden är ansluten med passiverade metalllinjer (dvs. med en skyddande beläggning applicerad på dess yta) på ingångs-/utmatningsdynor placerade vid den motsatta änden av nätstrukturen. Dessa I/O-kuddar, i tur och ordning, ansluts sedan till Flat Flexible Cables (FFC) och ansluts till externt system för inspelning. Forskarna genomförde också systematiska postimplantationsstudier, hitta minimala eller frånvarande neurala immunsvar, och dessutom att hjärnvävnaden hade penetrerat och smält samman med nätsonden. Forskarna noterar att nätimplantatet kanske aldrig behöver tas bort - men om det gör det, att göra det skulle vara ett enkelt om inte problemfritt förfarande. De drar slutsatsen att de flesta områden inom grundläggande neurovetenskaplig forskning skulle kunna dra nytta av mesh-elektronik som ger långsiktig stabilitet och en-neuronupplösning – unika egenskaper som inte finns i konventionell neuroprotetik – och anger i sin uppsats att ultraflexibla öppna mesh-elektroniksonder i framtiden skulle kunna möjliggöra en brett utbud av möjligheter för in vivo kronisk registrering och modulering av hjärnaktivitet.
Kemisk biologi Mark Hyman Jr. Professor i kemi Charles Lieber diskuterade artikeln att han, Huvudförfattare doktorand Tao Zhou, Postdoktor Guosong Hong, och deras kollegor publicerade i Proceedings of the National Academy of Sciences . "Den största utmaningen med att designa och implantera en injicerbar ultraflexibel öppen mesh-sond är att säkerställa att designen har fyra nyckelfunktioner, ", berättar Lieber Phys.org . Dessa faktorer är nätöppningar större än cellkroppar för att underlätta genomträngning av nervceller; nätelementfunktioner som är av samma storlek eller mindre än neuroner; flexibilitet som i denna studie var många storleksordningar större än neuronernas; och nätelektronik som enkelt kan injiceras genom nålar med mycket hög gauge för att exakt kontrollera nätpositionen. "Genom att designa nätelektroniken så att alla nyckelegenskaper är neuromorfiskt lika neurala vävnader, vi eliminerar kroniskt immunsvar som finns med alla andra sonder och medicinska implantat, som är mer som taggar i din vävnad."
Som tidigare nämnts, forskarnas 2015 papper initierade konceptet med spruta injicerbar elektronik, vilket Lieber noterar öppnar upp ett nytt fält med många möjligheter som väntar på ytterligare studier – ett exempel är saminjektion av elektronik och celler där meshelektronik också fungerar som en vävnadstillväxtställning som är relevant för regenerativ medicin. "I uppsatsen som diskuteras häri rapporterar vi systematiska tidsberoende kroniska histologiska studier av vävnad-mesh-gränssnittet efter att nätsonderna implanterades i gnagarhjärnor. Både horisontella (som innehåller tvärsnitt av implanterade nätsonder) och sagittala (som innehåller nästan hela de implanterade nätsonderna) hjärnskivor användes för immunhistokemi och färgades med antikroppar som kan rikta in sig på neuron somata, axoner, astrocyter och mikroglia. Resultaten i detta dokument avslöjar det unika med mesh-prober när det gäller minimal eller frånvaro av vävnadssvar och neuronpenetration när de implanteras kroniskt i hjärnan.
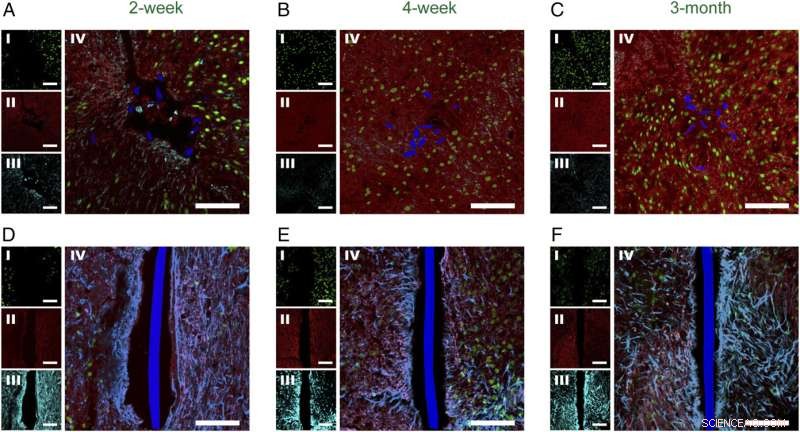
Fig. 2. Tidsberoende histologi av horisontella vävnadsskivor som innehåller implanterad meshelektronik och flexibla tunnfilmssonder. Konfokala fluorescensmikroskopbilder av horisontella vävnadsskivor som innehåller meshelektronik/flexibla tunnfilmssonder vid 2 veckor ( A och D ), 4 veckor ( B och E ), och 3 mån ( C och F ) postimplantation. I alla paneler var bildetiketterna NeuN ( jag , grön), NF ( II , röd), GFAP ( III , cyan), och NeuN, NF, GFAP-komposit ( IV ). Nätelektroniken och de flexibla tunnfilmstvärsnitten är pseudofärgade blå. (Skala staplar i alla bilder, 100 μm.) Kredit:Zhou T, Hong G, Fu TM, Yang X, Schuhmann TG, Robert D. Viveros, RD, Lieber CM (2017) Sprutan-injicerbar mesh-elektronik integreras sömlöst med minimalt kroniskt immunsvar i hjärnan. Proc Natl Acad Sci USA 114(23):5894-5899.
Forskarna använde standardfotolitografi för att tillverka mesh-elektroniksonderna med en polyimidbaserad fotoresist (polyimider är biokompatibla) i en treskiktsstruktur;
1. bottennätstrukturen (vanligtvis ~400 nm tjock) definieras enligt den specifika designen
2. metallen ansluter, ingångs-/utgångsplattor, och hjärnelektroder definieras, dessa är ~100 nm tjocka
3. det översta lagret av polyimidresist är definierat så att all metall är inkapslad utom I/O-kuddarna och elektroderna, där tillvägagångssättet och efterföljande polymerbearbetning leder till en robust nästan monolitisk struktur <1 um i tjocklek
Lieber påpekar att den neuromorfa naturen hos meshelektroniksonderna är relaterad till ovanstående tre punkter, den bio/neurala kompatibiliteten hos polyimidpolymeren som används för nätet, och den öppna tredimensionella nätstrukturen efter implantation. Tillsammans, han lägger till, dessa egenskaper gör den injicerade meshelektroniken ganska lik neurala nätverk som består av hjärnvävnad, och därför helt skild från konventionella sonder.
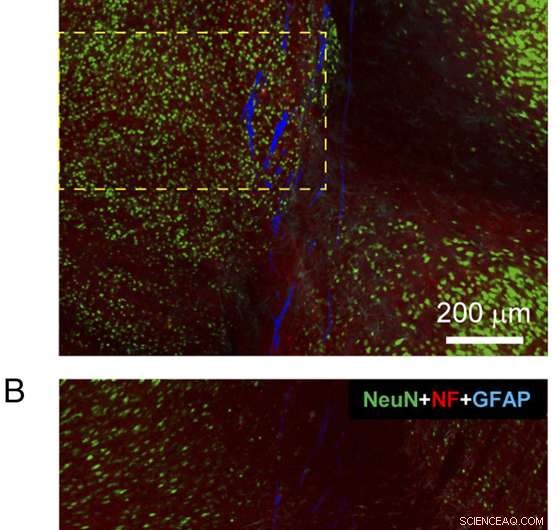
Fig. 4. Histologi av en sagittal vävnadsskiva som innehåller nästan hela den implanterade mesh-elektroniksonden. ( A och B ) Konfokala fluorescensmikroskopbilder av en sagittal vävnadsskiva inklusive meshelektroniksonden vid 3 månaders postimplantation. Var och en av bilderna är 3×3 sammansatta bilder inspelade direkt i Tile Scan-läget, där varje komponentbild av Tile Scan hade ett synfält på 425 μm × 425 μm. Vävnadsskivan färgades med antikroppar för NeuN (grön), NF (röd), och GFAP (cyan); nätet visas som pseudofärgat blått. Bilderna spelades in i ett optiskt fokalplan ca. 5 μm under ytorna på sida-A ( A ) och sida-B ( B ). ( C ) Fluorescensintensitet som funktion av avståndet från gränsen för nätelektroniken i bilder av sida-A ( A ) och sida-B ( B ). De rosa skuggade områdena indikerar insidan av meshelektronik på varje sida. NF- och GFAP-fluorescensintensiteten analyserades baserat på hela bilderna, och NeuN-fluorescensintensiteten analyserades baserat på de regioner som visas i gula streckade rutor i A och B . Felstaplar representerar SEM. Kredit:Zhou T, Hong G, Fu TM, Yang X, Schuhmann TG, Robert D. Viveros, RD, Lieber CM (2017) Sprutan-injicerbar mesh-elektronik integreras sömlöst med minimalt kroniskt immunsvar i hjärnan. Proc Natl Acad Sci USA 114(23):5894-5899.
"De största utmaningarna med att visa att sonderna inte framkallar inflammation eller ärrbildning - till skillnad från det typiska kroniska vävnadssvaret - är att karakterisera vävnadsnätgränssnittet vid olika tidpunkter efter implantation, " förklarar Lieber. För att åstadkomma detta, utan att ta bort implanterade nätsonder delade forskarna upp mushjärnor i både tvärsnitts- och longitudinella eller sagittala (vänster/höger) skivor. "Undersökningar av både tvär- och längsgående sektioner med den implanterade mesh-elektroniksonden gav detaljerade och globala vyer, respektive, av sond/vävnadsinteraktion, " noterar han, betonar att i de flesta fall måste konventionella sonder måste avlägsnas från vävnaden innan sektionering, vilket resulterar i förlust av viss kritisk gränssnittsinformation.
"De horisontella och sagittala hjärnskivorna - som innehåller tvärsnitt av implanterade nätsonder, och nästan hela den implanterade mesh-sonden, respektive — färgades med antikroppar som kan rikta in sig på neuron somata, axoner, astrocyter och mikroglia, "Liber fortsätter, Dessutom, han påpekar att dessa studier visade att till skillnad från konventionella sonder, neuron somata och axoner runt mesh-sonder skadades inte, och ledde till naturliga vävnadsnivåer vid mesh-sondens yta. "Liknande, markörerna för immunsvarsinflammation som framhävde astrocyter och mikroglia visade att dessa arter blev bakgrundsnivåer efter bara ett par veckor i meshelektroniken - men de förökade sig och ackumulerades vid gränssnitten mellan konventionella sonder." Forskarna fann också att förmågan att tillåta neuronerna och nätet som ska tränga in i varandra är universella för alla nät de injicerade och avbildade 6 ~ 12 veckor efter injektion, uppmanade dem att initiera ytterligare experiment för att ta reda på hur storleken på nätelektronikens strukturella element och andra parametrar kan anpassas för att förbättra förmågan till interpenetration av neuroner.
Det bör noteras, Lieber berättar Phys.org , att forskarna är konservativa när de i sin uppsats skriver ett minimalt immunsvar i väntan på mer detaljerade marköranalyser. "Faktiskt, vi tror att det inte finns något immunsvar från nätet eftersom våra resultat visar att varje initial förbättring av astrocyter och mikroglia återgår till bakgrunden utan någon mätbar skillnad nära eller distalt till sonden efter 12 veckor – och, som visas i vår 2016 Naturmetoder papper 1 – upp till minst ett år. Vi tror alltså att responsen beror på akut skada som uppstår vid införande av nålen (eller för den delen, någon sond) in i hjärnan – men med tanke på bristen på immunsvar från mesh-sonden, denna akuta skada läker med tiden, i motsats till försämring, som är fallet med konventionella sonder."
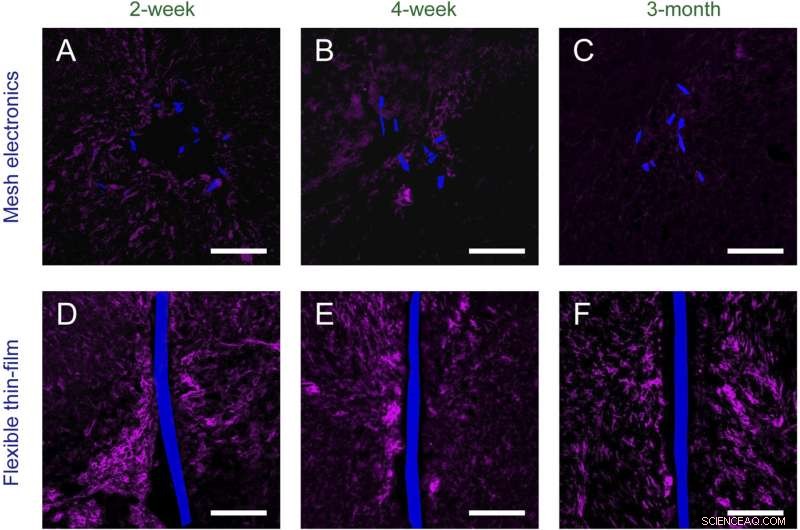
Fig. S2. Tidsberoende histologi av kroniskt implanterad meshelektronik ( A – C ) och flexibla tunnfilmssonder ( D – F ) i mösshjärnor (horisontella sektioner). Vävnadsskivor är märkta med Iba-1 (magenta) för att markera mikroglia; nätelektronik och flexibla tunnfilmssonder avbildades av DIC och är pseudofärgade blå. (Skala staplar i alla bilder, 100 μm.) Kredit:Zhou T, Hong G, Fu TM, Yang X, Schuhmann TG, Robert D. Viveros, RD, Lieber CM (2017) Sprutan-injicerbar mesh-elektronik integreras sömlöst med minimalt kroniskt immunsvar i hjärnan. Proc Natl Acad Sci USA 114(23):5894-5899.
Den minimala, återvinningsbar akut skada och frånvaron av ett immunsvar stödjer möjligheten att meshelektronik kan vara permanent livskraftig. "Enligt våra tidigare och pågående studier hittills, mesh-sonder kan upprätthålla en stabil registrerings-/stimuleringsgränssnitt med hjärnvävnaden i minst ett till två år, " säger Lieber. "Men, denna tidsperiod representerar inte den förväntade livslängden eftersom pågående studier för närvarande pågår för att visa stabilitet på längre sikt." På grund av begränsningen av gnagarens livslängd på två till tre år, forskarna förväntar sig att hitta mer omfattande stabilitet hos längre levande däggdjur som rhesusmakaker och i studier som för närvarande pågår. "I fallet med frånvarande immunsvar som visats i vår senaste tidning, den förväntade livslängden för meshelektronik bör endast bestämmas av biokompatibilitet och livslängd för materialen, inklusive metallelektroderna (guld och platina, som båda är inerta), och den passiverande polymeren som har studerats omfattande i tidigare publikationer (som Nemani et al 2 ) för att visa långsiktig stabilitet under fysiologiska tillstånd). Därför, vi förblir övertygade om att meshelektronik sannolikt kommer att ha en förväntad livslängd med stabilt neuralt gränssnitt och inspelnings-/stimuleringsfunktioner i flera år, och föreställ dig nätet i slutändan som livstidsimplantat."
Dock, Lieber tillägger, om nätet behöver tas bort, det kan extraheras direkt med minimal kraft och skada på hjärnan. "Medan detta kan orsaka en liten mängd skador på grund av sömlös integration med neural vävnad, vi tror att den oöverträffade stabiliteten och frånvaron av kroniskt immunsvar i vår neurala vävnadsliknande meshelektronik kommer att leda till en paradigmförändring där sonden är en livslång implantation som inte kräver borttagning."
Går vidare, Lieber säger att de genomför pågående studier av nya nätdesigner med ett stort antal elektroder och multisite-injektioner. "Dessutom, våra nästa steg inkluderar implantationer av meshelektronik i andra vävnader och organ än hjärnan – till exempel, i ögat för in vivo registrering av enstaka retinala ganglieceller, i ryggmärgen, i muskeln för att studera signalutbredning vid den neuromuskulära korsningen, och så vidare. Vi börjar också studier som utnyttjar den oöverträffade stabiliteten och frånvaron av kroniskt immunsvar hos meshelektroniken i modeller för Alzheimers och Parkinsons sjukdom, och arbetar med implantation av meshelektronik i icke-mänskliga primater och mänskliga patienter."
De ser också ett brett utbud av nuvarande och potentiella applikationer som drar nytta av användningen av deras mesh-sond, inklusive ryggmärgs- och neuromuskulära junctionimplantat, gränssnitt mellan hjärna och maskin, cyborgdjur, naturligt och patologiskt åldrande (som Alzheimers sjukdom) med insikt om hur rumsligt minne och inlärning utvecklas som en funktion av ålder och sjukdomsstadium. Dessutom, genom att lägga till stimuleringselektroder, att kunna möjliggöra återkoppling på fin nivå som kan förbättra eller övervinna de kognitiva försämringar som är förknippade med åldrande och andra neurodegenerativa sjukdomar.
När det gäller andra forskningsområden som kan dra nytta av deras studie, Lieber säger att i allmänhet, de flesta områden inom grundläggande neurovetenskaplig forskning skulle kunna dra nytta av meshelektronikens unika kapacitet för långsiktig stabilitet och enstaka neuronupplösning. "Dessutom, nästan alla kliniska/medicinska applikationer som involverar elektriska inspelningar och/eller stimulanser kommer att dra nytta av våra studier. Utöver det som nämnts ovan, " avslutar han, "the mesh electronics should provide unique opportunities for brain-machine interfaces for tetraplegic patients, deep brain stimulations for the treatment of Parkinson's disease, and neural prosthetics in general."
© 2017 Phys.org