Alla celler utsöndrar extracellulära vesiklar i nanoskala naturligt som lipid-dubbelskiktsavgränsade partiklar. Därför är de giltiga biomarkörer för att identifiera en mängd olika sjukdomar.
Det är viktigt att effektivt isolera små extracellulära vesiklar samtidigt som man bibehåller utbytet och renheten för att utforska deras potential i diagnostiska, prognostiska och terapeutiska tillämpningar.
Konventionella metoder för isolering har brister, som inkluderar låg renhet och avkastning, långa extraktionsprocedurer, specialiserad utrustning och höga kostnader.
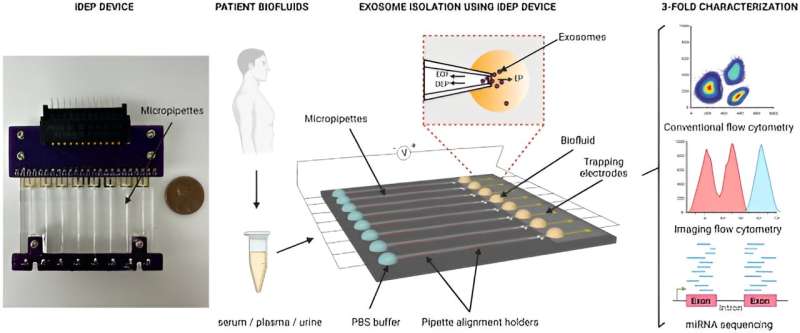
I en studie publicerad i Scientific Reports , Manju Sharma och ett team av forskare inom biomedicinsk teknik vid University of Cincinnati Ohio U.S., utvecklade en ny isolatorbaserad dielektroforetisk enhet för att snabbt isolera små extracellulära vesiklar från biovätskor och cellodlingsmedia, baserat på deras dielektriska egenskaper.
Forskarna karakteriserade de små extracellulära vesiklar som isolerats från biovätskor från cancerpatienter med hjälp av instrumentet och genomförde en trefaldig karakterisering med konventionell flödescytometri, avancerad avbildningsflödescytometri och mikroRNA-sekvensering för att erhålla ett högt utbyte av rena extracellulära vesiklar. Plattformen är effektiv för att snabbt isolera biomarkörer och bibehålla vesiklarnas biomolekylära integritet.
Biologiskt sett är små extracellulära vesiklar membraninkapslade biologiska kärl som finns i biovätskor såsom blod, urin, saliv, sperma, bröstmjölk och cerebrospinalvätska; frigörs av celler i det extracellulära utrymmet.
Sådana vesiklar i nanoskala kan horisontellt överföra sin biomolekylära last för att fungera som intercellulära signalvektorer. Sådana extracellulära vesiklar ger en hög grad av känslighet och specificitet på grund av deras utmärkta stabilitet. Deras tidiga upptäckt i flytande biopsier kan förbättra upptäckten av cancer, infektioner och neurodegenerativa och metabola sjukdomar.
Isoleringen av vesiklarna är dock utmanande på grund av deras storlek i nanoskala och fysikalisk-kemiska egenskaper. Isoleringsmetoder beror vanligtvis på egenskaperna hos de extracellulära vesiklarna, och även om sådana enheter har lovande egenskaper, är deras tillverkningskostnader, provspädning och känslighet för igensättning inneboende utmaningar.
Som svar utvecklade Sharma och kollegor en klass av nya isolatorbaserade dielektroforetiska metoder med mikropelare i mikrofluidkanaler för att snabbt uppsluka nanopartiklar baserat på deras storlek och unika dielektriska egenskaper.
Enheten upprätthöll en rad mikropipetter som är kapabla att isolera nanopartiklar från små provvolymer genom att applicera ett signifikant lågt elektriskt fält över pipetternas längd. Arkitekturen för porgeometrin möjliggjorde isolering av extracellulära vesiklar från små provvolymer av konditionerade cellodlingsmedier och biovätskor från friska donatorer.
I detta arbete isolerade Sharma och team biovätskorna från cancerpatienter, vilket inkluderade serum, plasma och urin, följt av multiparametrisk karakterisering via flödescytometri och nästa generations miRNA-sekvensering.
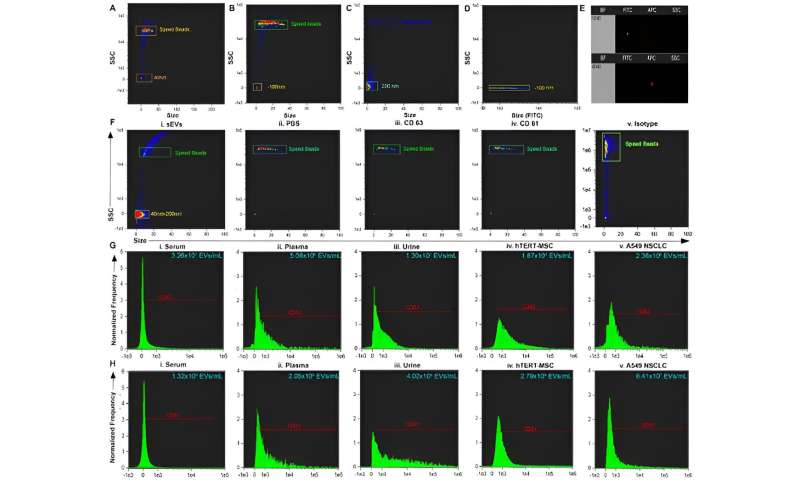
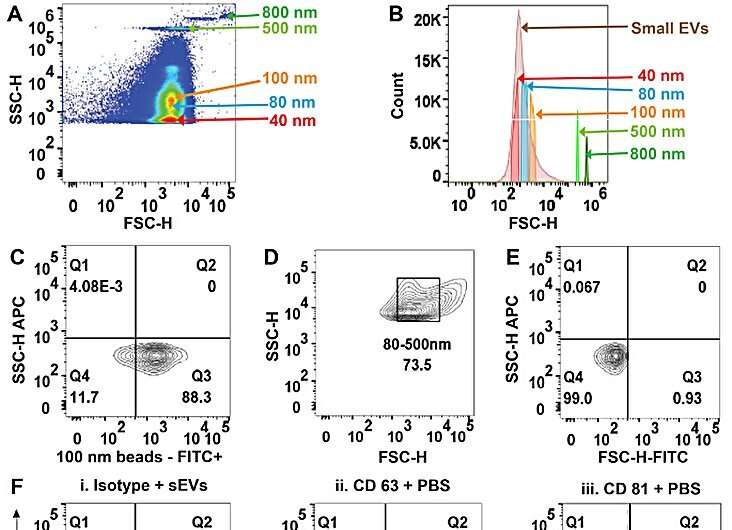
Teamet renade små extracellulära vesiklar från serum, plasma och urin i fosfatbuffrad saltlösning genom att använda den isolatorbaserade dielektroforetiska metoden. Sharma och kollegor använde transmissionselektronmikroskopi för att bekräfta närvaron av vesiklarna och utforskade multiparametrisk analys av renade cirkulerande små extracellulära vesiklar via flödescytometri.
Teamet isolerade vesiklarna och analyserade dem, följt av konventionella flödescytometristudier. Forskarna visade vidare enhetens kapacitet och användning genom att karakterisera isolaten genom programvaran ImageStream.
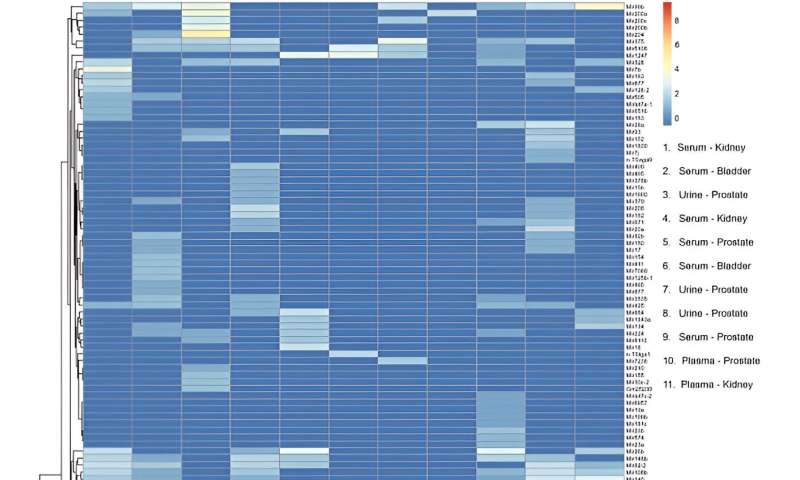
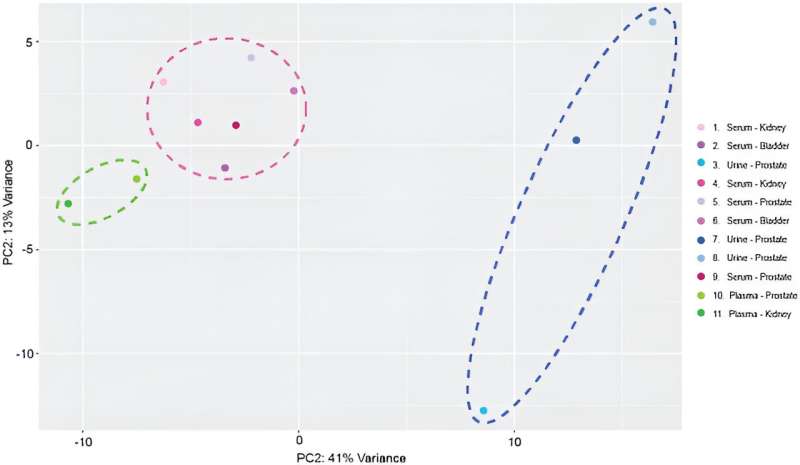
Efter miRNA-sekvensering kartlade teamet 137 distinkta, mogna miRNA-transkript till det mänskliga genomet över prover för att inkludera enheten i miRNA-biomarköranalysarbetsflöden. De genomförde transkriptomiska profiler och utförde huvudkomponentanalys.
Outlook
På detta sätt visade Manju Sharma och kollegor kapaciteten och effektiviteten hos en lågspännings-, etikettfri isolatorbaserad dielektroforetisk enhet för att isolera små extracellulära vesiklar från serum, plasma och urin från cancerpatienter genom sub-mikron partikeldetektering, och multiparametrisk karakterisering genom att använda konventionell flödescytometri och avancerade flödescytometrimetoder.
RNA-koncentrationerna i arbetet var jämförbara med tidigare arbeten och bekräftade att isoleringsmetoden var ett gångbart alternativ till de som redan etablerats i labbet. De analytiska metoderna kan vara användbara som flytande biopsiplattformar för att isolera små extracellulära vesiklar och utveckla extracellulära vesikelbaserade diagnostik- och övervakningsplattformar.
Mer information: Manju Sharma et al, Snabb rening och multiparametrisk karakterisering av cirkulerande små extracellulära vesiklar med hjälp av en etikettfri lab-on-a-chip-enhet, Scientific Reports (2023). DOI:10.1038/s41598-023-45409-4
Journalinformation: Vetenskapliga rapporter
© 2023 Science X Network