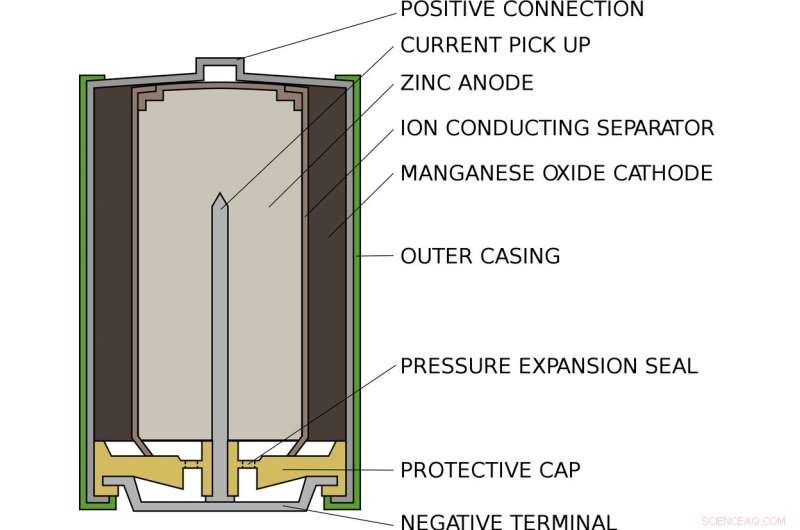
Hur ett vanligt AA alkaliskt batteri ser ut på insidan. Upphovsman:Leadinnehavare/Wikimedia Commons
Smartphone-eran är bara drygt ett decennium gammal, men de fickformade datorerna i kärnan i den samhälleliga omvandlingen är bara möjliga på grund av en annan teknik:litiumjonbatterier.
Såldes först kommersiellt 1991 av Sony för sina videokameror, dessa typer av batterier är bra för mycket mer än bärbar konsumentelektronik. De står i centrum för två andra tekniska revolutioner med kraften att förändra samhället:övergången från förbränningsmotorer till elfordon, och övergången från ett elnät som drivs av fossila bränslen till förnybara energigeneratorer som lagrar överskottsel i batterier för framtida användning.
Så hur fungerar dessa batterier? Forskare och ingenjörer har ägnat hela sin karriär åt att bygga bättre batterier och det finns fortfarande mysterier som vi inte helt förstår. För att förbättra batterier krävs att kemister och fysiker tittar på förändringar på atomnivå, samt mekaniska och elektriska ingenjörer som kan designa och montera de batteripaket som driver enheter. Som materialvetare vid University of Washington och Pacific Northwest National Lab, mitt arbete har hjälpt till att utforska nya material för litium-luftbatterier, magnesiumbatterier och naturligtvis litiumjonbatterier.
Låt oss betrakta en dag i livet för två elektroner. Vi kommer att namnge en av dem Alex och han har en vän som heter George.
Batteri anatomi
Alex bor i ett standard alkaliskt AA-batteri, som i din ficklampa eller fjärrkontroll. Inuti ett AA -batteri, det finns ett fack fyllt med zink och ett annat fyllt med manganoxid. På ena sidan, zinken hänger bara svagt på elektroner som Alex. I andra änden, manganoxiden drar kraftfullt elektroner mot sig själv. Mellan, stoppar elektronerna från att gå direkt från en sida till en annan, är ett papper blötlagt i en lösning av kalium och vatten, som samexisterar som positiva kaliumjoner och negativa hydroxidjoner.
När batteriet sätts i en enhet och slås på, enhetens interna krets är klar. Alex dras ur zinket, genom kretsen och in i manganoxiden. Längs vägen, hans rörelse driver enheten, eller glödlampa eller vad som helst som är anslutet till batteriet. När Alex går, han kan inte komma tillbaka:Zinket som har tappat en elektronbindning med hydroxiden för att bilda zinkoxid. Denna förening är extremt stabil och kan inte lätt omvandlas till zink.
På andra sidan batteriet, manganoxiden får en syreatom från vattnet och lämnar hydroxidjoner kvar för att balansera ut den hydroxid som förbrukas av zinken. När alla Alex grannar har lämnat zinken och flyttat till manganoxiden, batteriet är urladdat och måste återvinnas.
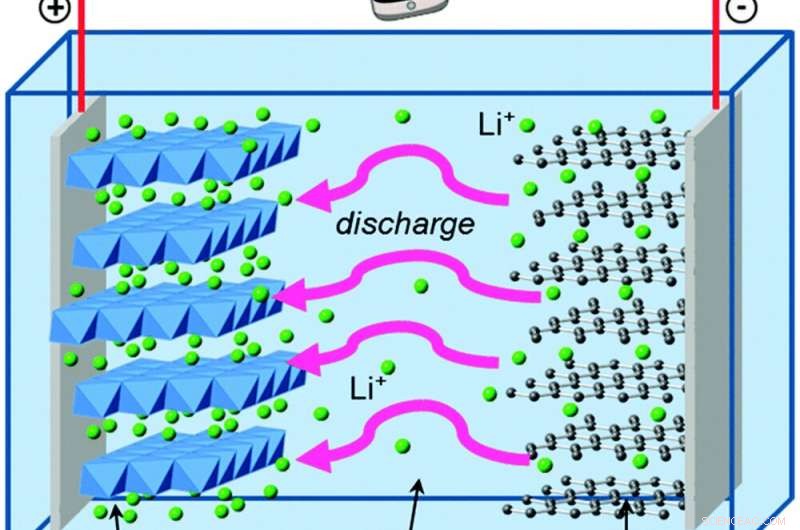
När elektroner rör sig utanför batteriet, litiumjoner rör sig inuti den för att behålla den elektriska jämvikten. Kredit:Islam och Fisher, Chemical Society recensioner, 2014., CC BY
Litiumjonfördelar
Låt oss jämföra detta med George, som lever i ett litiumjonbatteri. Litiumjonbatterier har samma grundläggande byggstenar som alkaliska AA-celler, med några skillnader som ger stora fördelar.
George lever i grafit, vilket är ännu svagare än zink när det håller i elektroner. Och den andra delen av hans batteri är litiumkoboltoxid, som drar elektroner mycket kraftfullare än manganoxid - vilket ger hans batteri förmågan att lagra mycket mer energi i samma mängd utrymme än ett alkaliskt batteri. Lösningen som skiljer grafit och litiumkoboltoxid innehåller positivt laddade litiumjoner, som lätt bildar och bryter kemiska bindningar när batteriet laddas ur och laddas.
Dessa kemiska reaktioner är reversibla, till skillnad från bildandet av zinkoxid, vilket är vad som låter elektronerna och litiumjonerna flöda fram och tillbaka under många cykler av laddning och urladdning.
Denna process är inte 100% effektiv, Men alla batterier förlorar så småningom sin förmåga att hålla energi. Ändå, familjen av litiumjonkemier har varit tillräckligt kraftfulla för att dominera batteritekniken idag.
Den här artikeln är återpublicerad från The Conversation under en Creative Commons-licens. Läs originalartikeln. 