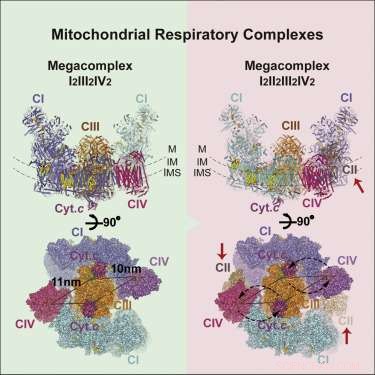
Respiratorisk megakomplex struktur. Kreditera: Cell (2017). DOI:10.1016/j.cell.2017.07.050
(Phys.org) - bit för bit, kretsschemat för elektrontransport i mitokondrierna har kommit närmare färdigställandet. Varje ny struktur som erhålls för något av de fem andningskomplexen begränsar ytterligare det sammansatta pusslet. Så småningom, stora block arrangeras i sina slutliga placeringar. Den exakta sammansättningen av det största blocket, den så kallade megakomplexet, har länge gäckat forskare. Nu, efter avbildning av 140 individuella subenheter ner till 3,9 anstroms upplösning, Full Monty har blottats. Forskare beskriver i Cell exakt hur det mänskliga respiratoriska megakomplexet är sammansatt och verkar fungera.
Borta är de enkla dagarna. Inga fler grova diagram med komplex uppradade i membranet i rad från ett till fem med elektroner och deras mobila bärare som sekventiellt färdas genom från vänster till höger. Ta på stökiometrin, och ta på 2-D. Stökiometri betyder att i verkligheten, varje komplex representeras faktiskt i megakomplexet vid ett specifikt kopianummer. Dessa extra kopior måste komma någonstans i någon korrekt representation. Inte bara det, men de mindre elektronbärarna behöver ett utrymme att umgås med. De måste också finnas i kanaler som antingen förblir lokala för megakomplexet eller eventuellt diffunderar till andra. Den slutliga geometrin kommer att bestämma var separata elektronbanor går samman eller delar sig, och där det är mest sannolikt att de kör baklänges.
Bilden av megakomplexet (MC) som har uppstått har följande stökiometri:MCI2II2III2IV2. Detta innebär att komplex I, II, III, &IV är var och en närvarande i duplikat medan komplex V är frånvarande. Den är konfigurerad inuti membranet till en cirkulär struktur med den dimera CIII placerad i mitten och matad av perifera CI- och CIV-komplex. CII-komplexen är uppenbarligen inte väsentliga krav på kärnstrukturen utan är snarare teoretiserade att kilas in i luckor efter behov. Författarna hittade också bevis för en lättviktig återgivning av megakomplexet som ibland kan sättas ihop med bara ett enda CI-komplex.
CIV -dimerns centrala positionering antyder en viss logik. CIV, eller cytokromoxidas, är den terminala vilojorden för elektroner som kommer in i kedjan. De som gör det så här långt har sänkts ned i reduktionspotentialhierarkin så långt de kan gå. Här, de sänks ner i väntande syremolekyler, som sedan förbrukas som vattenmolekyler. Elektroner med hög potential förpackade när NADH kommer in i komplexet vid dess omkrets och trattas in i mitten. Frånvaron av C5-komplex kanske inte är så ovanlig, med tanke på att de vanligtvis finns som rader av "V'-formade dimerer som förvränger membranet till områden med hög krökning vid krökar i cristea.
Med den grundläggande strukturen i hand, forskarna kunde föreslå några grundläggande driftsprinciper. Deras införande och placering av CII förklarar effektivt omvänd elektrontransport från succinat till NADH. Den föreslagna geometrin skapar också en förseglad Q-pool (en lipidlöslig elektronbärare) som är tillgänglig för både CI och CII. Författarna kunde också peka ut identiteten och placeringen av flera lipidmolekyler som säkrar komplexet i membranet, specifikt, flera pivotala molekyler av fosfatidyletanolamin, fosfatidylkolin, och kardiolipin. De kunde också identifiera föredragna eller mest effektiva elektronöverföringsvägar, vilket i sin tur begränsar hur många elektroner som samtidigt kan överföras mellan aktiva bärare.
Bland de omedelbara fördelarna med detta nya arbete är att många av de tidigare ofullständigt förstådda patogena mutationerna i respiratoriska proteiner nu är meningsfulla. Innan man har någon megakomplex struktur, forskare hade inget annat val än att fokusera på hur mutationer påverkar strukturen eller funktionen hos enskilda komplex. Som det visar sig, de flesta av de registrerade mutationerna i kärnsubenheterna Ci och CIII-mål är i rester involverade i protein-proteininteraktionsställen mellan komplex. (Till exempel, sjukdomsassocierade mutationer i underenheter NDUFV1, NDUFS1, ND1, ND5, och ND6 i CI och subenhet MT-CYB i CIII). Detta visar meningslösheten i att bara försöka titta på enstaka proteiner och subenheter i frånvaro av den större bilden.
Det bör nämnas att tidigare försök att definiera respiratorisk komplex stökiometri har fått något olika resultat beroende på vilka organ och arter som studerats. Potatis, ko, får, och jäst, som inte alltid ens har ett CI-komplex att tala om, har alla studerats. Det är inte förvånande att olika omständigheter kan kräva olika stökiometri och form. Olika megakomplexa strukturer skulle medföra olika fördelar för substratkanalisering, katalytisk förbättring, sekvestrering av reaktiva intermediärer, eller strukturell stabilisering. En studie som specifikt tittade på hjärtats mitokondrier satte förhållandet för oxidativ fosforyleringskomplex I:II:III:IV:V till 1:1,5:3:6:3. I detta fall, författarna kallade deras komplex för "respirasomen".
Med andnings -megakomplexet nu förmodligen spräckt, nästa stora steg framåt är att sprida några av de andra överbyggnaderna i det mitokondriella dubbelmembransystemet till modeller för att förutsäga varför cristea ser ut som de gör. De massiva TIM-TOM-importkomplexen spänner över båda membranen och är intimt associerade med mitoribosomerna som översätter mitokondriella proteiner. mitoribosomerna, i tur och ordning, är lokaliserade till underliggande membranassocierade nukleoider som innehåller kopior av mtDNA. I analogi med kärnans kärna, denna sammansatta nukleoid-ribosomstruktur har kallats "mitokondriol." Andra kritiska importkomplex finns i blandningen av aktörer som tävlar om kritiska membranfastigheter. Malat-aspartat-skytteln, till exempel, är den viktigaste skytteln i hjärnan och ekvilibrerar stora metaboliter mellan mitokondrier och cytosol. Citrat-pyruvat-skytteln för fettsyrasyntes och glycerolfosfatskytteln (åtminstone för brunt fett och insektsflygmuskler) måste också hitta hem där de kan komma överens med de närmaste grannarna.
Den endemiska organisationen av proteiner i dessa megastrukturer tyder på att mitokondrier kan likna en hård kristall mer än en flytande protoplasma. Men på något sätt, de verkar anmärkningsvärt smidiga när det gäller fusion och fission. Vad händer med deras membranstruktur under den här typen av förändringar? Är komplexen tillfälligt isärtagna och solubiliserade som den primära cilium och centriol i vanliga celler under mitos? En fascinerande ny ledtråd dyker upp från arbete som visar att mitokondrier ansluter till varandra genom "nanotunnlar" av sin egen konstruktion. Dessa nanotunnlar är helt olika (så vitt vi vet) från det cytoskelettinfunderade märket av "tunnelerande nanorör" som celler själva använder för att överföra hela mitokondrier till varandra.
En ny recension från Martin Picard och hans kollegor i Trender inom cellbiologi föreslår ett sätt att dessa nanotunnlar kan bildas när mitokondrier fixeras till cytoskelettet. Om motorproteiner som kinesin får tag i en del av en fixerad mitokondrier, det kan dra ut en tunn nanotunnel när kinesinet driver mot en annan mikrotubuli. Mitokondriernas stela kropp och dess membranstruktur skulle förmodligen förbli intakt. Denna projektion kan sedan möta en annan mitokondrier som den blir fäst vid.
Picard har tidigare visat att ungefär hälften av mitokondrierna i hjärtmuskeln har intermitokondriella korsningar (IMJs) och cristae som radas upp i regelbundna mönster som sträcker sig över mitokondriella nätverk. Denna otrevliga nätverksanpassning kommer sannolikt inte att uppstå från de senaste klyvningshändelserna eftersom hjärt mitokondrier är fixerade på plats och visar minimal fission/fusionsdynamik. IMJs har nyligen visat sig kontrollera kontraktiliteten genom att snabbt koppla bort mitokondrier när deras egna membran depolariseras. En sak som skulle vara av omedelbart intresse, här, är att ompröva respiratorisk subenhetsstökiometri i mänskliga hjärtmitokondrier för att komplettera resultaten som rapporteras här för mänskliga embryonala njurceller.
© 2017 Phys.org