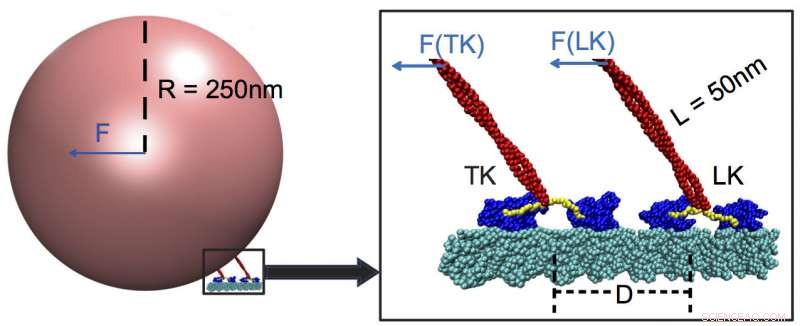
Två lastbärande kinesiner när de bär last längs en mikrotubuli (cyan). Forskare från Rice University och University of Houston fastställde att motorproteiner reagerar bäst på starka krafter och knappast alls på svaga, även de som appliceras av motorer kopplade till samma last. I det här exemplet, det ledande kinesinet (LK) bär det mesta av lasten, med motorhuvuden (blå) aktiverade av en halslänk (gul) som ansluter till skaftet (röd) och känner av lastens närvaro. Kredit:Centrum för teoretisk biologisk fysik/Rice University
Om du är motorproteinet i framkant, var beredd att göra det tunga draget.
Det är en slutsats från en Rice University-ledd studie av mekanismerna som driver kinesiner, motorproteiner som bär last inuti celler. Studien visar att det krävs mycket motkraft för att bromsa en bestämd kinesin. Inte heller får proteinet mycket hjälp av kollegor som tar upp baksidan.
Den teoretiska studien som beskrivs i Proceedings of the National Academy of Sciences och ledd av Rice postdoktorala forskare Qian Wang var ett samarbete mellan laboratoriet för tre professorer vid Rice och en vid University of Houston, alla arbetar under paraplyet av Rice's Center for Theoretical Biological Physics (CTBP).
De hoppas kunna öka kunskapen om de föga förstådda arbetshästarna inuti celler som är avgörande för celldelning såväl som lasttransport. Defekta eller bristfälliga kinesiner är inblandade i Charcot-Marie-Tooths sjukdom och vissa njursjukdomar.
Genom datorsimuleringar, forskarna ger de första detaljerna på molekylär nivå om hur kinesiner reagerar på yttre krafter samtidigt som de bekräftar tidigare experiment av medförfattaren Michael Diehl som visade att grupper av kinesiner fungerar bäst bara när de är i närheten och kan dra i samma riktning.
"Vi förstår mer eller mindre enskilda motorer, " sa Rice biofysiker och medförfattare Anatoly Kolomeisky, vars tidigare forskning visade att motorproteiner är känsliga för närvaron av andra. "I naturen, de arbetar i team, men eftersom motorerna reagerar relativt svagt på ett betydande spektrum av krafter, vi hävdar att detta är huvudorsaken till att kinesins inte alltid samarbetar med varandra."
Kinesiner omvandlar energi från den kemiska ATP, eller adenosintrifosfat, till mekanisk verkan. De fäster sig vid stora laster som mitokondrier eller kromosomer och drar dem längs cytoskeletttrådarna till de avlägsna delarna av en cell. Varje kinesin innehåller två "huvud" underenheter, och varje subenhet innehåller två bindningsställen – en för att greppa och gå längs mikrotubuli och den andra för att binda ATP.
Modellerna visade kinesiner, en familj av motormolekyler som upptäcktes 1985, är "svagt mottagliga" för små eller medelstora yttre krafter och drar sin last genom allt utom mycket stark opposition. Bland de svaga krafterna finns de som appliceras av släpande kinesiner fästa på samma last.
Det visar sig att dessa lagkamrater knappt registrerar sig för chefens kinesin om de är mer än 48 nanometer bort. När så är fallet, blykinesin bär mer än 90 procent av belastningen.
Rissimuleringarna avslöjade att ledaren ägnar mer uppmärksamhet åt själva lastens drag, som utlöser en "switch" i nacklänken, del av stjälken som drar lasten som ett snöre på en ballong. Länkaren kopplar lasten till huvudmotorernas ATP-bindningsställen, som i sin tur styr hastigheten. En släpande kinesin som är för långt bort känner inte av kraften och kan därför inte bidra med sin muskel.
"När motorn rör sig, nacklänken blir ansträngd, " sa Rice biofysiker José Onuchic, en medförfattare och meddirektör för CTBP. "Om den länken inte är ansträngd, motorn tappar hastighet eftersom den inte kan fatta ett beslut på egen hand. Denna konkurrens mellan spänning och bindning till mikrotubuli behövs för att garantera processiviteten hos denna motor."
Bassimuleringen kommer att tillåta forskare att testa fler kinesiner som flyttar last från kärnan till cellens yttre gränser och, så småningom, dyniner, större och mer komplexa proteiner som flyttar last mot centrum.
"Du måste göra det här första steget riktigt bra och mycket detaljerat för att få förtroende innan du tar dig an ett best som dynein, ", sa Diehl. "De här killarna har arbetat mycket hårt i flera år genom flera studier och dragit ihop, kollektivt, ett sätt att räkna upp och analysera övergångarna mellan nyckelsteg i denna mekaniska process.
"Nu, att kunna ta den inställningen till en motor som dynein har möjligheten att förklara mycket viktigt, grundläggande mysterier om hur ett protein som komplex fungerar, " han sa.
"Det är den typen av undersökning som en enda huvudutredare skulle ha svårt att göra, " Sa Onuchic. "För problem som är så komplicerade, det är bra att ha den här kombinationen av talang."