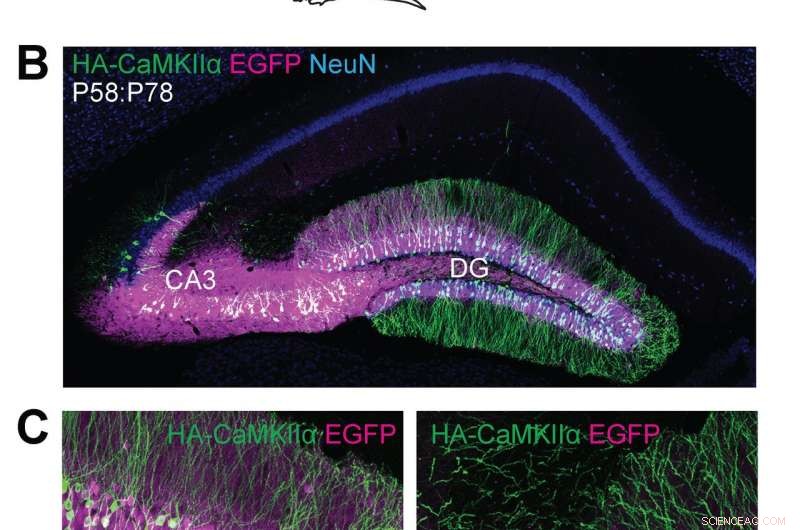
(A) Schematiska illustrationer av experiment. (B, C) Konfokala mikroskopiska bilder av koronala hjärnsektioner av hippocampus hos Cas9 -möss, visar EGFP -fluorescensen (B, C, magenta), immunreaktivitet för NeuN (B, blå) och HA-taggen (B, C, grön) smält till N-terminalen av endogen CaMKIIa. Kredit:Max Planck Florida Institute for Neuroscience
Genomredigeringsteknologier har revolutionerat biomedicinsk vetenskap, ger ett snabbt och enkelt sätt att modifiera gener. Dock, tekniken som gör det möjligt för forskare att utföra de mest exakta redigeringarna, fungerar inte i celler som inte längre delar sig - vilket inkluderar de flesta neuroner i hjärnan. Denna teknik hade begränsad användning inom hjärnforskning, tills nu. Forskarassistent Jun Nishiyama, M.D., Ph.D., Forskare, Takayasu Mikuni, M.D., Ph.D., och vetenskaplig chef, Ryohei Yasuda, Ph.D. vid Max Planck Florida Institute for Neuroscience (MPFI) har utvecklat ett nytt verktyg som, för första gången, möjliggör exakt genomredigering i mogna neuroner, öppnar stora nya möjligheter inom neurovetenskaplig forskning.
Detta nya och kraftfulla verktyg använder den nyupptäckta genredigeringstekniken från CRISPR-Cas9, en viral försvarsmekanism som ursprungligen hittades i bakterier. När den placeras inuti en cell som en neuron, CRISPR-Cas9-systemet skadar DNA på en specifikt riktad plats. Cellen reparerar därefter denna skada med övervägande två motsatta metoder; en är icke-homolog ändkoppling (NHEJ), som tenderar att vara felbenägen, och homologistyrd reparation (HDR), som är mycket exakt och kapabel att genomgå specificerade geninsättningar. HDR är den mer önskade metoden, ger forskare flexibilitet att lägga till, ändra, eller ta bort gener beroende på det avsedda syftet.
Att locka celler i hjärnan att i första hand använda HDR-DNA-reparationsmekanismen har varit ganska utmanande. HDR ansågs ursprungligen endast vara tillgänglig som en reparationsväg för aktivt prolifererande celler i kroppen. När prekursorhjärnceller mognar till neuroner, de kallas post-mitotiska eller icke-delande celler, gör den mogna hjärnan i stort sett otillgänglig för HDR – eller så trodde forskare tidigare. Teamet har nu visat att det är möjligt för postmitotiska neuroner i hjärnan att aktivt genomgå HDR, benämner strategin "vSLENDR (viral medierad encellsmärkning av endogena proteiner genom CRISPR-Cas9-medierad homologi-riktad reparation)." Den avgörande nyckeln till framgången för denna process är den kombinerade användningen av CRISPR-Cas9 och ett virus.
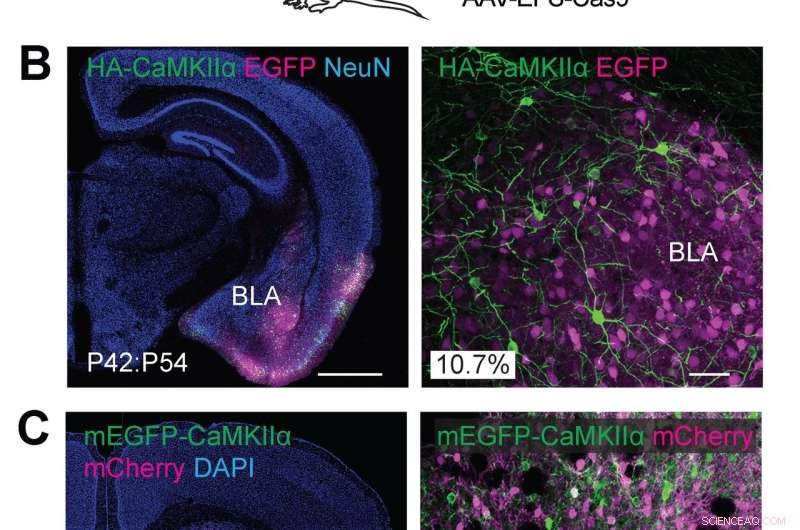
(A) Schematiska illustrationer av experiment. (B) Konfokala mikroskopiska bilder av koronala hjärnsektioner av amygdala hos vildtypsmöss, visar EGFP-fluorescensen (B, magenta), immunreaktiviteter för NeuN (vänster) och HA-taggen (grön) fusionerad till N-terminalen för endogen CaMKIIα. (C) Konfokala mikroskopiska bilder av koronala hjärnsektioner av striatum hos vildtypsmöss, visar DAPI-signal (vänster), mCherry fluorescens (magenta), mEGFP-fluorescensen (grön) smält till N-terminalen av endogent CaMKIIa. Kredit:Max Planck Florida Institute for Neuroscience
Adenoassocierat virus (AAV) är ett lågimmunogent, icke-toxiskt virus som används av forskare som en effektiv leveransmekanism för alla typer av gener. Detta virus kan effektivt tillhandahålla den donatormall som behövs för HDR, öka dess effektivitet. Teamet packade först det nödvändiga maskineriet för genomredigering i AAV och levererade det till neuroner hos transgena Cas9-uttryckande möss, uppnå spektakulärt effektiv HDR i postmitotiska neuroner i hjärnan.
Därefter skapade de ett dubbelviralt system som gjorde det möjligt för dem att använda tekniken i djur som inte hade konstruerats för att uttrycka Cas9. De testade detta dubbelvirala system i en åldrad musmodell med Alzheimers sjukdom, vilket visade att vSLENDR-tekniken kan tillämpas i patologiska modeller även i höga åldrar.
vSLENDR är ett kraftfullt nytt verktyg för både grundläggande och translationella vetenskaper, kapabel till exakt redigering av genetisk information oavsett celltyp, cellmognad, hjärnområdet, eller ålder. Den nya vSLENDR är mer effektiv, flexibel, och kortfattad, ger forskare möjlighet att studera en myriad av hjärnprocesser och funktioner med oöverträffad lätthet. Lika viktigt är dess potentiella användning i neuropatologiska sjukdomsmodeller, påskynda forskning och utveckling av nya terapier; etablerar dagens grundläggande vetenskap som grunden för morgondagens botemedel.
Studien publiceras i Nervcell .