När man jämförde genuttrycksmönstren för 26 arter med olika livslängder, fann Rochester-biologerna Vera Gorbunova och Andrei Seluanov att egenskaperna hos de olika generna kontrollerades av cirkadiska eller pluripotensnätverk. Kredit:University of Rochester illustration / Julia Joshpe
Naturligt urval har producerat däggdjur som åldras med dramatiskt olika hastigheter. Ta till exempel nakna mullvadsråttor och möss; den förra kan leva upp till 41 år, nästan tio gånger så lång som gnagare av liknande storlek som möss.
Vad står för längre livslängd? Enligt ny forskning från biologer vid University of Rochester ligger en nyckelbit i pusslet i mekanismerna som reglerar genuttryck.
I en artikel publicerad i Cell Metabolism , forskarna, inklusive Vera Gorbunova, Doris Johns Cherry-professorn i biologi och medicin; Andrei Seluanov, professor i biologi och medicin; och Jinlong Lu, en postdoktor vid Gorbunovas labb och den första författaren till artikeln, undersökte gener kopplade till livslängd. Deras forskning avslöjade specifika egenskaper hos dessa gener och avslöjade att två regulatoriska system som kontrollerar genuttryck - cirkadiska och pluripotensnätverk - är avgörande för livslängden. Fynden har implikationer både för att förstå hur livslängden utvecklas och för att tillhandahålla nya mål för att bekämpa åldrande och åldersrelaterade sjukdomar.
Jämföra livslängdsgener
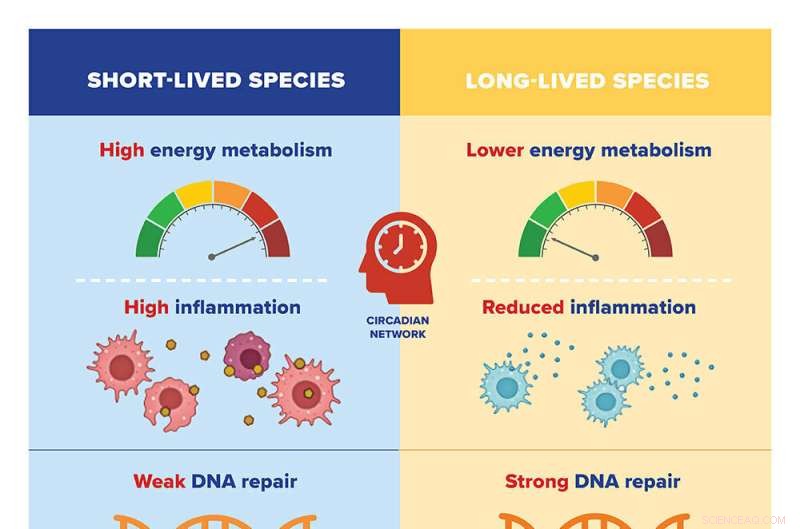
Forskarna jämförde genuttrycksmönstren för 26 däggdjursarter med olika maximala livslängder, från två år (smuss) till 41 år (nakna mullvadsråttor). De identifierade tusentals gener relaterade till en arts maximala livslängd som antingen var positivt eller negativt korrelerade med livslängden.
De fann att långlivade arter tenderar att ha lågt uttryck av gener involverade i energimetabolism och inflammation; och högt uttryck av gener involverade i DNA-reparation, RNA-transport och organisering av cellskelett (eller mikrotubuli). Tidigare forskning av Gorbunova och Seluanov har visat att egenskaper som effektivare DNA-reparation och en svagare inflammatorisk respons är karakteristiska för däggdjur med lång livslängd.
Motsatsen gällde för kortlivade arter, som tenderade att ha högt uttryck av gener involverade i energimetabolism och inflammation och lågt uttryck av gener involverade i DNA-reparation, RNA-transport och mikrotubuliorganisation.
Två pelare för lång livslängd
När forskarna analyserade mekanismerna som reglerar uttrycket av dessa gener, fann de två stora system i spel. De negativa livslängdsgenerna - de som är involverade i energimetabolism och inflammation - kontrolleras av dygnsnätverk. Det vill säga deras uttryck är begränsat till en viss tid på dygnet, vilket kan bidra till att begränsa det totala uttrycket av generna i långlivade arter.
Detta innebär att vi kan utöva åtminstone viss kontroll över generna för negativ livslängd.
"För att leva längre måste vi upprätthålla hälsosamma sömnscheman och undvika exponering för ljus på natten eftersom det kan öka uttrycket av de negativa livslängdsgenerna", säger Gorbunova.
Å andra sidan styrs positiva livslängdsgener – de som är involverade i DNA-reparation, RNA-transport och mikrotubuli – av det som kallas pluripotensnätverket. Multipotensnätverket är involverat i omprogrammering av somatiska celler – alla celler som inte är reproduktionsceller – till embryonala celler, som lättare kan föryngras och regenereras, genom att ompaketera DNA som blir oorganiserat när vi åldras.
"Vi upptäckte att evolutionen har aktiverat pluripotensnätverket för att uppnå längre livslängd", säger Gorbunova.
Pluripotensnätverket och dess förhållande till positiva livslängdsgener är därför "ett viktigt fynd för att förstå hur livslängden utvecklas", säger Seluanov. "Dessutom kan det bana väg för nya antiaging-interventioner som aktiverar de viktigaste positiva livslängdsgenerna. Vi förväntar oss att framgångsrika antiaging-interventioner skulle innefatta att öka uttrycket av de positiva livslängdsgenerna och minska uttrycket av negativa livslängdsgener."