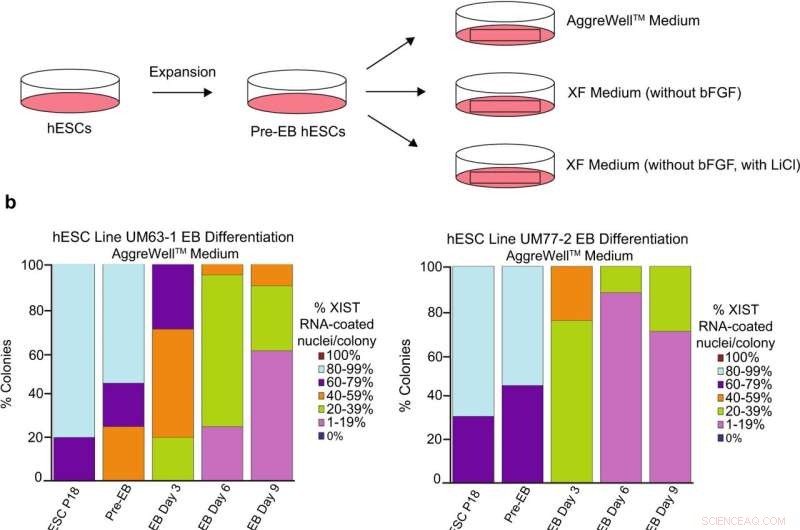
Analys av XIST RNA-beläggning under differentiering av kvinnliga hESCs. ett schema över hESC-differentiering till embryoidkroppar (EB) med tre olika mediaformuleringar:en kommersiellt tillgänglig AggreWell TM medium; XF-medium som saknar bFGF; och XF-medium som saknar bFGF men innehåller 0,98 mM LiCl. b Procentandel av kärnor med XIST RNA-beläggning i EBs genererade från hESC-linjerna UM77-2 och UM63-1. EB:er genererade och odlade i XF-medium med LiCl och AggreWell TM medium förlorade en betydande andel XIST RNA-beläggning per koloni jämfört med EB:er som genererats och odlats i XF-medium (allmän linjär modelljämförelse; p < 0,001). Minst 100 kärnor räknades per koloni för kvantifiering av hESC RNA FISH. Det totala antalet kolonier som kvantifierats vid varje passage varierar mellan 10 och 17 och är katalogiserade i källdata. Källdata tillhandahålls som en källdatafil. Kredit:Nature Communications (2022). DOI:10.1038/s41467-022-30259-x
Hos de flesta däggdjur har honor två X-kromosomer och hanar har en X- och en Y-kromosom i var och en av sina celler. För att undvika en dubbel dos av X-länkade gener hos honor tystas ett av X:en tidigt i utvecklingsprocessen. Denna tystnad är kritisk, men hur det går till har varit relativt mystiskt. Två nya U-M-studier avslöjar mer om denna tystnadsprocess och insikter som kan förbättra stamcellsforskningen.
Mänskliga embryonala stamceller (hESC) har enorma löften för forskning om tidig utveckling såväl som för regenerativ medicin för sjukdomar som sträcker sig från typ 1-diabetes till Parkinsons sjukdom. Ändå stöter biologer som arbetar med kvinnliga hESCs i labbet ofta in i ett fenomen där den normalt inaktiverade X-kromosomen förlorar denna undertryckning medan den växer i en odlingsskål.
"Om du inte kan upprätthålla hESCs exakt som sådana i kulturen så kan du inte använda dem för någon nedströms tillämpning", säger Sundeep Kalantry, Ph.D., docent i human genetik. Han, tillsammans med Marissa Cloutier, en Ph.D. praktikant och deras team försökte avgöra varför X-inaktivering urholkas under vissa experimentella förhållanden över tid.
Deras primära misstänkta var ämnet som användes för att odla cellerna i kultur, kallat media. Celler odlas i media som förser dem med kemiska instruktioner som kallas tillväxtfaktorer. Dessa tillväxtfaktorer signalerar stamceller att fortsätta dela sig. Ett populärt medium, kallat mTeSR1, verkade vara korrelerat med förlusten av en nyckelregulator för X-inaktivering, en icke-kodande RNA-sträng som kallas XIST. Ett annat medium, kallat Xenofree, ledde inte till en förlust av X-inaktivering.
"Vi tittade på skillnaderna i sammansättningen av dessa två medier och identifierade att litiumklorid fanns i mTeSR1 men inte i Xenofree", säger Cloutier.
Litiumklorid ingår ibland i media för att främja stamcellsproliferation, men det är känt att interferera med många cellsignaleringsvägar genom att hämma GSK-3-proteiner. (Hämmare av GSK-3-proteiner har använts för att behandla flera sjukdomar, och litium, som används för att behandla bipolär sjukdom, var en av de första naturliga GSK-3-hämmarna som upptäcktes.)
För att bekräfta litiumklorid som boven tillsatte de föreningen till Xenofree-mediet och såg en förlust av X-inaktivering. Deras artikel publiceras i Nature Communications .
"I stort sett när det gäller vår förståelse av X-inaktivering ger vår studie en möjlig ny modell för reglering av denna process", säger Cloutier. Kalantry tillägger att deras studie tyder på att forskare måste vara lite mer försiktiga med användningen av GSK-3-hämmare som litium. "De kan inte bara störa X-inaktivering, utan andra sätt för epigenetisk transkriptionsreglering över genomet."
Roll för en gammal X-länkad gen för att inducera X-inaktivering
En separat artikel, även publicerad i Nature Communications av Kalantry och kollegor, ger insikter i utvecklingen av X-inaktivering hos däggdjur. Utgångspunkten för studien var att X-inaktivering utlöses av en eller flera av en undergrupp av X-länkade gener som paradoxalt nog undkommer X-inaktivering när X-inaktivering väl har börjat. Dessa gener uttrycks från både X-kromosomer hos honor jämfört med ett enda X hos män, och som ett resultat är de mer uttryckta hos kvinnor jämfört med män. Kalantrys labb i nära samarbete med Shigeki Iwases labb, också vid University of Michigan, fann att på grund av det högre uttrycket hos kvinnor jämfört med män av en sådan X-länkad gen, Kdm5c, inducerar den Xist och därmed X-inaktivering selektivt hos kvinnor .
Att ta bort Kdm5c på båda X-kromosomerna i en kvinnlig cell stängde nästan helt av X-inaktiveringen. Omvänt, när forskarna introducerade Kdm5c i manliga musceller, initierade de framgångsrikt X-inaktivering, vilket under normala omständigheter inte skulle inträffa.
Kdm5c är en förfäders X-länkad gen som delas av alla däggdjursarter. Författarna testade och fann att Kdm5c från evolutionärt avlägsna pungdjur och monotrema (t.ex. äggläggande platypus) däggdjurslinjer, som splittrades från placenta däggdjur för mer än 150 miljoner år sedan, också på ett anmärkningsvärt sätt kunde inducera Xist- och X-inaktivering i manliga musceller . Detta fynd tyder på att Kdm5c har behållit en förfäders funktion för att inducera Xist och X-inaktivering hos möss och människor.
"Om man uttrycker X-länkade gener på högre nivåer än normalt i en kvinnlig cell, kommer den cellen ofta att lida och dö. Hos män, om man minskar uttrycket av X-länkade gener utöver normala nivåer genom att inaktivera det enda X, celler lider och dör också, säger Kalantry. "Rätt nivå av X-kromosomgener är verkligen, verkligen viktig för cellens hälsa."
Teamet hoppas härnäst kunna förklara den slumpmässiga processen som avgör vilket X i en kvinnlig cell som tystas:det från mamman eller det från pappan. Att bestämma denna grundläggande mekanism, säger Kalantry, skulle i framtiden kunna användas för att återaktivera X-kopplade gener efter behag för potentiella terapeutiska ändamål.