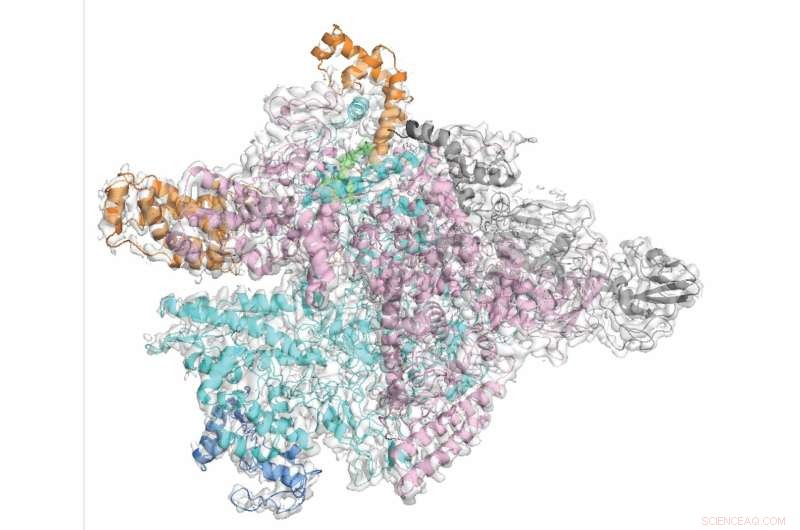
Forskarna visade på molekylär nivå hur fidaxomicin selektivt riktar sig mot C. diff samtidigt som de skonar de oskyldiga bakteriella åskådare. Kredit:Rockefeller University
De flesta antibiotika är tveeggade svärd. Förutom att döda patogenen de är ordinerade för, decimerar de också nyttiga bakterier och ändrar sammansättningen av tarmmikrobiomet. Som ett resultat blir patienterna mer benägna att återinfektion, och läkemedelsresistenta stammar är mer benägna att uppstå.
Svaret på detta problem kan vara smalspektrumantibiotika som dödar endast en eller några få arter av bakterier, vilket minimerar risken för sidoskador. I en nyligen genomförd studie tog Rockefeller-forskare en närmare titt på ett sådant antibiotikum, fidaxomicin, som används för att behandla Clostridium difficile, eller C. diff, en av de vanligaste vårdrelaterade infektionerna. Forskarna visade på molekylär nivå hur fidaxomicin selektivt riktar sig mot C. diff samtidigt som de skonar de oskyldiga bakteriella åskådare.
Fynden, detaljerade i Nature , kan hjälpa forskare i kapplöpningen att utveckla nya smalspektrumantibiotika mot andra patogener.
"Jag vill att människor, forskare och läkare ska tänka annorlunda om antibiotika", säger Elizabeth Campbell, forskningsdocent vid Rockefeller. "Eftersom vår mikrobiom är avgörande för hälsan har smalspektrumtillvägagångssätt en viktig roll att spela i hur vi behandlar bakterieinfektioner i framtiden."
Enigmatiskt selektiv
C. diff är en toxinproducerande bakterie som kan inflammera tjocktarmen och orsaka svår diarré. Det infekterar ungefär en halv miljon människor i USA, mestadels på sjukhus, och ungefär en av elva av dem över 65 år som dör inom en månad.
I flera år har läkare använt bredspektrumantibiotika för att behandla C. diff. Fidaxomicin är ett relativt nytt alternativ som beviljades FDA-godkännande 2011.
Liksom flera andra antibiotika, inklusive tuberkulosläkemedlet rifampicin, riktar sig fidaxomicin mot ett enzym som kallas RNA-polymeras (RNAP), som bakterien använder för att transkribera sin DNA-kod till RNA. För att förstå exakt varför fidaxomicin selektivt hämmar RNAP i C. diff och inte i de flesta andra bakterier, slog Campbell ihop med biokemisten Robert Landick från University of Wisconsin-Madison för att visualisera C. diff RNAP med hjälp av kryoelektronmikroskopi, en kraftfull bildteknik som kan avslöja 3D-formen av molekyler och fånga läkemedelsmolekylen och dess mål i aktion. "Även om den övergripande arkitekturen för RNAP i olika bakterier är likartad, finns det fortfarande betydande skillnader," säger Campbell.
Spionerar på RNAP
En stor utmaning var dock att först producera stora mängder C. diff, en anaerob grodd som inte växer i närvaro av syre. Studiens första författare, Xinyun Cao, från Landick Lab, ägnade två år åt att utveckla ett system för att enklare producera C. diff RNAP med hjälp av E. Coli, en lättväxande bakterie som ofta används i labbet.
Med hjälp av detta material genererade medförstaförfattaren Hande Boyaci, en postdoc i Campbells team, bilder av C. diff RNAP låst med fidaxomicin i nära atomär upplösning. Inkilad i ett gångjärn mellan två underenheter av RNAP, fidaxomicin sylt öppnar enzymets tång, vilket hindrar det från att ta tag i genetiskt material och starta transkriptionsprocessen.
Genom att noggrant undersöka kontaktpunkterna mellan RNAP och fidaxomicin, identifierade forskarna en aminosyra på RNAP som binder till fidaxomicin men som saknas i huvudgrupperna av tarmmikrober som skonas av fidaxomicin. En genetiskt förändrad version av C. diff som saknade denna aminosyra var opåverkad av fidaxomicin, precis som andra kommensala bakterier i tarmen. Omvänt blev bakterier som fick det tillsatt till sitt RNAP känsliga för fidaxomicin.
Fynden tyder på att denna ena aminosyra bland de 4 000 aminosyrorna i denna robusta och essentiella transkriptionsmaskin är dess akilleshäl, ansvarig för dödandet av bakterierna med fidaxomicin.
Metoden som används i denna studie föreslår en färdplan för att utveckla nya och säkrare antibiotika, säger forskarna. Genom att ytterligare belysa RNAP-strukturen hos olika bakterier kan forskare designa antibiotika som riktar sig mot varje patogen mer selektivt och effektivt.