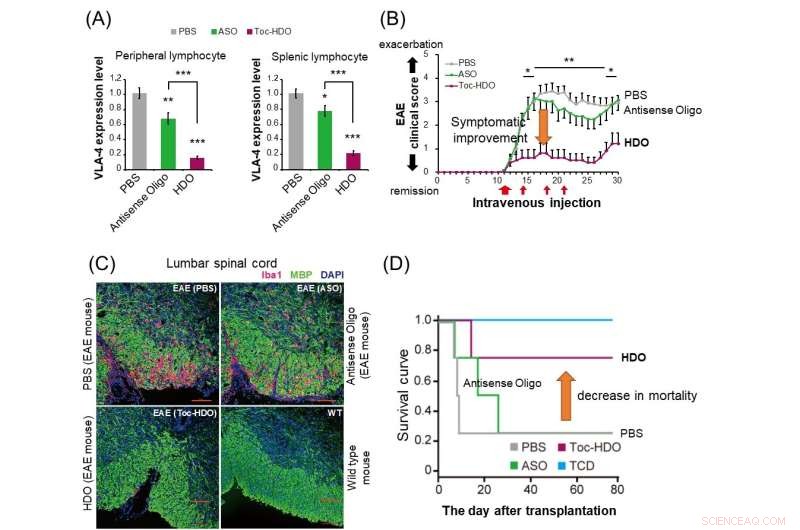
(A) Hos normala möss undertrycker administrering av HDO (röd stapel) mer drastiskt α4β1-integrin-genuttrycket i perifera och mjältlymfocyter jämfört med antisens-oligonukleotid (grön stapel). (B) Hos experimentell autoimmun encefalomyelit (EAE) möss har administrering av HDO riktad mot α4β1-integrin efter symptomdebut visat förbättring i klinisk poäng. (C) Administrering av HDO inriktat på α4β1-integrin före uppkomsten av EAE-möss resulterar i minskad Iba1-positiv inflammatorisk cellinfiltration (röd) och förbättrad demyelinisering (grön) i ländryggmärgen.(D) I musmodellen av graft-versus -host-disease (GVHD), transplantation av mjälthärledda T-celler tillsammans med benmärgsceller efter behandling med HDO riktad mot α4β1-integrin förbättrade överlevnadskurvan. TCD:Transplanterade benmärgsceller utan T-celler härledda från mjälte. Kredit:Institutionen för neurologi och neurologi, TMDU
T- och B-lymfocyter, som ingår i en grupp immunceller som vanligtvis kallas vita blodkroppar, arbetar tillsammans för att eliminera främmande inkräktare i kroppen, såsom virus. Vissa sjukdomar kan dock uppstå när T- och B-celler aktiveras vid olämpliga tidpunkter, inklusive autoimmuna sjukdomar och olika cancerformer. I en nyligen publicerad artikel i Nature Communications , ett team som leds av forskare vid Tokyo Medical and Dental University (TMDU) beskriver en teknologi som kallas en heteroduplex oligonukleotid (HDO) som de utvecklade för att leverera till lymfocyter och reglera deras funktioner.
Genuttryck är roten till att kontrollera cellulär aktivitet. Sjukdom kan uppstå när vissa gener antingen stängs av felaktigt eller uttrycks okontrollerat. Därför har forskare haft som mål att utveckla terapeutiska metoder för att återställa genuttrycksnivåerna till deras friska tillstånd, helst endast i de onormala cellerna. En sådan modalitet är att leverera specifikt konstruerade DNA- eller RNA-molekyler som kan lokalisera de feluttryckta genmeddelandena och styra cellen att sänka dem tillbaka till normala nivåer. Den svåraste delen av detta är dock att säkerställa att de terapeutiska molekylerna effektivt kan nå sin rätta destination utan att degraderas av cellen.
"Vårt team designade en DNA/RNA-hybridmolekyl som kallas HDO", säger huvudförfattaren till studien Masaki Ohyagi. "Den specifika sekvensen för HDO kan ändras för att rikta in sig på en speciell gen av intresse, medan dess ryggrad gör den stabil i celler."
En viktig del av teamets HDO-design är tillägget av en molekyl som kallas α-tokoferol, vilket är avgörande för korrekt leverans. Eftersom α-tokoferol är väsentligt för korrekta lymfocytiska immunsvar, tillåter tillägg av detta att HDO kan levereras i perifert blod och riktas till lymfocyter. Teamet designade HDO för flera musgener och injicerade dem sedan intravenöst i labbmöss.
"Vi fann att vår HDO-teknik kunde specifikt tysta dessa gener i muslymfocyter mer robust och stabilt, och även med mindre toxicitet, än andra tidigare versioner av denna metod", säger Takanori Yokota, senior författare till artikeln. "Våra studier visade också att HDO:erna kommer in i dessa celler genom en process som kallas endocytos."
Efter att ha upptäckt att deras teknik var effektiv för att tysta gen, undersökte TMDU-teamet om det kunde vara användbart som en sjukdomsbehandling. De designade en HDO riktad mot en gen som heter Itga4, som är central för patogenesen av experimentell autoimmun encefalomyelit (EAE), en musmodell för multipel skleros (MS).
"Intravenös injicering av dessa möss med en Itga4-inriktad HDO fördröjde uppkomsten och förbättrade EAE-symtom och minskade både inflammatorisk cellinfiltration och ryggmärgsdemyelinisering", förklarar Ohyagi.
Detta arbete visar de kraftfulla genljudande effekterna av HDO-tekniken, såväl som dess överlägsna leveransförmåga jämfört med andra liknande metoder. Det mest betydande var att den Itga4-specifika HDO kunde förbättra resultaten i en MS-musmodell, vilket tyder på att den kan vara användbar som ett nytt terapeutiskt medel som kan utvecklas för mänskliga immunförmedlade sjukdomar.