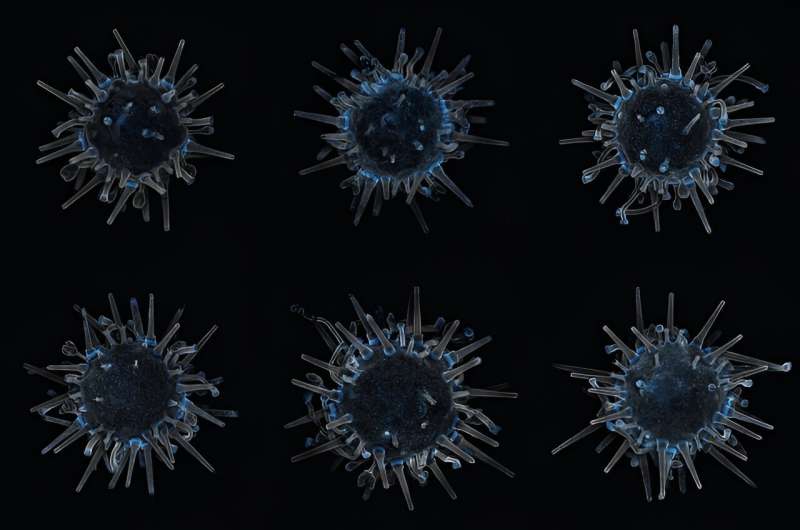
Tänk på sjöborren. Närmare bestämt den målade urchin:Lytechinus pictus, en taggig pingisboll från östra Stilla havet.
Arten är en mindre och kortare ryggrad kusin till purpurborrarna som slukar kelpskogar. De producerar ett enormt antal spermier och ägg som befruktas utanför deras kroppar, vilket gör det möjligt för forskare att se processen för skapandet av urchin på nära håll och i stor skala. En generation ger upphov till nästa om fyra till sex månader. De delar mer genetiskt material med människor än vad fruktflugor gör och kan inte flyga iväg – kort sagt ett idealiskt försöksdjur för utvecklingsbiologen.
Forskare har använt sjöborrar för att studera cellutveckling i ungefär 150 år. Trots urchins status som superreproducerare tvingar praktiska problem ofta forskare att fokusera sitt arbete på mer lättillgängliga djur:möss, fruktflugor, maskar.
Forskare som till exempel arbetar med möss kan beställa djur online med de specifika genetiska egenskaper de hoppas kunna studera – transgena djur, vars gener har manipulerats på konstgjord väg för att uttrycka eller undertrycka vissa egenskaper.
Forskare som arbetar med sjöborrar måste vanligtvis spendera en del av året på att samla in dem från havet.
"Kan du föreställa dig om musforskare satte en råttfälla varje natt, och vad det än är de fångade är vad de studerade?" sa Amro Hamdoun, professor vid UC San Diegos Scripps Institution of Oceanography.
Marina ryggradslösa djur representerar cirka 40 % av djurvärldens biologiska mångfald, men förekommer ändå i en knapp bråkdel av en procentandel av djurbaserade studier. Tänk om forskare kunde komma åt sjöborrar lika lätt som möss? Tänk om det var möjligt att tillverka och föda upp rader av transgena borrar?
"Vet du hur alla gjorde surdeg under pandemin? Jag är inte bra på att göra surdeg," sa Hamdoun nyligen på sitt kontor i Scripps' Hubbs Hall. Han siktade istället på ett projekt av en annan sort:ett nytt transgent labbdjur, "en fruktfluga från havet."
I mars publicerade Hamdouns labb en artikel om bioRxiv preprint-server som visar framgångsrikt införande av en bit främmande DNA – närmare bestämt ett fluorescerande protein från en manet – i genomet av en målad urchin som skickade förändringen till sin avkomma.
Resultatet är den första transgena sjöborren, en som råkar glöda som en julglödlampa under ett fluorescerande ljus. (Artikeln har skickats in för peer review.)
Djuren är de första transgena tagghudarna, den filum som inkluderar sjöstjärnor, sjögurkor och andra marina djur. Hamdouns uppdrag är att göra genetiskt modifierade borrar tillgängliga för forskare var som helst, inte bara för de som råkar arbeta i forskningsanläggningar i utkanten av Stilla havet.
"Om du tittar på några av de andra modellorganismerna, som Drosophila [fruktflugor], zebrafiskar och mus, så finns det väletablerade resurscentra", säger Elliot Jackson, postdoktor vid Scripps och huvudförfattare till artikeln. "Om du vill ha en transgen linje som märker nervsystemet, kan du förmodligen få det. Du kan beställa det. Och det är vad vi hoppas att vi kan vara för sjöborrar."
Att kunna genetiskt modifiera ett djur överladdar vad forskare kan lära sig av det, med implikationer långt bortom varje enskild art.
"Det kommer att förvandla sjöborrar som en modell för att förstå neurobiologi, för att förstå utvecklingsbiologi, för att förstå toxikologi", säger Christopher Lowe, professor i biologi från Stanford som inte var involverad i forskningen.
Laboratoriets genombrott, och dess fokus på att göra djuren fritt tillgängliga för andra forskare, kommer "tillåta oss att utforska hur evolutionen har löst många riktigt komplicerade livsproblem", sa han.
Forskare tenderar att studera möss, flugor och liknande inte för att djurens biologi är bäst lämpad för att svara på deras frågor utan för att "alla verktyg som var nödvändiga för att få fram dina frågor byggdes upp i bara ett fåtal arter", säger Deirdre Lyons , en docent i biologi vid Scripps som arbetade med Hamdoun på tidig forskning relaterad till projektet.
Att utöka utbudet av djur som är tillgängliga för sofistikerat labbarbete är som att lägga till färger till en konstnärs palett, sa Lyons, "Nu kan du gå och få den färg du verkligen vill ha, som bäst passar din vision, snarare än att vara fast med några få modeller. "
På bottenvåningen i Hamdouns kontorsbyggnad ligger experimentakvariet Hubbs Hall, ett garageliknande utrymme fullproppat med tankar fulla av cirkulerande havsvatten och ett brokigt utbud av marint liv.
Vid ett besök nyligen sträckte sig Hamdoun ner i en tank och tog försiktigt bort en målad sjöborre. Den susade med överraskande hastighet över en utsträckt handflata, som om den skulle utforska främmande terräng.
Den sista gemensamma förfadern till L. pictus och Homo sapiens levde för minst 550 miljoner år sedan. Trots de olika evolutionära vägarna vi sedan dess vandrat avslöjar våra genom ett gemensamt biologiskt arv.
De genetiska instruktionerna som driver omvandlingen av en enda zygot till en levande kropp är slående lika i våra två arter. Specialiserade system skiljer sig från ett enstaka befruktat ägg och översättningen av ett virrvarr av proteiner till en enda levande varelse – på cellnivå, allt detta fortskrider ungefär på samma sätt för borrar och människor.
Dessa djur är "verkligen grundläggande för vår förståelse av hela livet", sa Hamdoun och placerade tillbaka urchin i sin tank. "Och historiskt sett väldigt otillgänglig genetiskt."
Det experimentella akvariet byggdes på 1970-talet, då att ösa liv ur havet var det enda sättet att skaffa forskningsexemplar. Några våningar upp i Hubbs Hall ledde Hamdoun vägen in i urchin plantskolan – den första storskaliga ansträngningen att föda upp flera generationer av djuren i ett laboratorium. Vid varje givet ögonblick har teamet 1 000 till 2 000 sjöborrar i olika utvecklingsstadier.
Rad på rad av små plasttankar stod mot en vägg, var och en innehöll en ungborre i linsstorlek. En remsa med tejp på varje tank noterade djurets genetiska modifiering och datum för befruktning. På vissa indikerade en andra bit av tejp djur som hade modifieringen i sina könscellers DNA, vilket betyder att det kan överföras till avkommor. (Av denna anledning håller labbet sina borrar noggrant åtskilda från den vilda populationen.)
"En av de stora frågorna inom hela biologin är att förstå hur serien av instruktioner i genomet ger dig vilken fenotyp du än vill studera," sa Hamdoun - i huvudsak hur strängen av aminosyror som är ett djurs genetiska kod ger upphov till till egenskaperna hos den levande, andande varelsen. "En av de grundläggande sakerna du måste göra är att kunna modifiera det genomet och sedan studera vad resultatet är."
Han pekade på en tank som innehöll en liten urchin från vars genetiska kod proteinet ABCD1 har klippts bort.
ABCD1 fungerar som en studsare, förklarade Hamdoun, parkerar längs cellmembranet och stöter ut främmande molekyler. Proteinets verkan kan bevara cellen från skadliga ämnen men kan ibland motverka en organisms bästa, som när det hindrar cellen från att absorbera en nödvändig medicin.
Forskare som använder urchins där det proteinet inte längre fungerar kan studera rörelsen av en molekyl genom en organism – DDT, till exempel – och mäta hur mycket av ämnet som hamnar i cellen utan den förvirrande interferensen från ABCD1. De kan omvända manipulera hur stor roll ABCD1 spelar för att förhindra en cell från att absorbera ett läkemedel.
Och så finns det de fluorescerande borrarna.
"Det magiska händer i det här rummet," sa Jackson och gick in i ett smalt kontor med mikroskop till ett värde av 1 miljon dollar i ena änden och en decennier gammal handvevad centrifug fastskruvad vid ett bord i en annan.
Han placerade en petriskål som innehöll tre transgena borrar i penna-raderstorlek under ett mikroskop. Vid 120 gånger sin storlek såg var och en ut som att Times Squares nyårsboll vaknade till liv – en glödande, vickande varelse med pentamerös radiell symmetri.
Fluorescens är inte bara ett tagghudsfesttrick. Att lysa upp cellerna gör det lättare för forskare att spåra deras rörelser i en organism under utveckling. Forskare kan se när de tidiga cellerna i en blastula delar sig och omorganiseras till neural eller hjärtvävnad. Så småningom kommer forskare att kunna stänga av enskilda gener och se hur det påverkar utvecklingen. Det kommer att hjälpa oss att förstå hur vår egen art utvecklas och varför den utvecklingen inte alltid går enligt plan.
Labbet har "gjort ett bra jobb. Det har verkligen välkomnats av samhället", säger Marko Horb, senior forskare och chef för National Xenopus Resource vid University of Chicagos marinbiologiska laboratorium.
Horb driver det nationella clearinghuset för genetiskt modifierade arter av Xenopus, en klogroda som används i laboratorieforskning. Centret utvecklar linjer av transgena grodor för vetenskapligt bruk och distribuerar dem till forskare.
Hamdoun föreställer sig ett liknande resurscenter för sitt labbs urchins. De har redan börjat skicka små injektionsflaskor med transgena spermier från urchin till intresserade forskare, som kan odla skräddarsydda urchins med ägg från Hamdouns labb eller annan källa.
Hamdoun minns livfullt den tid han tillbringade tidigare i sin karriär med att försöka spåra upp slumpmässiga bitar av DNA som är nödvändiga för hans forskning, besvikelsen och frustrationen över att skriva till professorer och före detta postdoktorer bara för att upptäcka att materialet länge hade gått förlorat. Han vill hellre att framtida generationer av forskare lägger sin tid på upptäckter.
"Biologi är verkligen intressant," sa han. "Ju fler människor kan få tillgång till det, desto mer kommer vi att lära oss."
Mer information: Elliot W. Jackson et al, Stabil könslinjetransgenes med användning av MinosTc1/marinerelementet i sjöborren, Lytechinus pictus, bioRxiv (2024). DOI:10.1101/2024.03.26.586777
Journalinformation: bioRxiv
2024 Los Angeles Times. Distribueras av Tribune Content Agency, LLC.