Den encelliga parasiten Cryptosporidium är en ledande orsak till dödlig diarrésjukdom hos små barn, och ett nyligen utbrott i Storbritannien visar hur sårbart vattenförsörjningen är för denna patogen.
Det finns inga effektiva läkemedel eller vacciner, vilket gör detta till en viktig organism att studera. Parasiten infekterar cellerna som kantar tarmarna och deltar i både asexuell och sexuell replikering, vilket forskare misstänker är både avgörande för ihållande infektion och överföring.
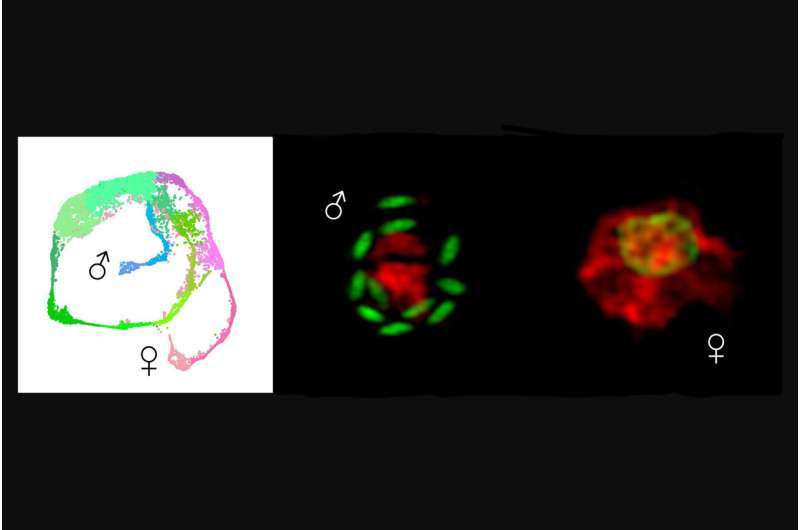
Men mekanismen genom vilken parasiten blir manlig eller kvinnlig är okänd. "Dessa parasiter har inte könskromosomer, som människans X eller Y", säger Katelyn A. Walzer, postdoktor vid Striepen Lab vid Penns School of Veterinary Medicine. "Att avslöja hur de väljer kön är av grundläggande biologiskt intresse och ger ett nytt nyckelmål för att blockera överföring och infektion."
Walzer är huvudförfattare till en studie, publicerad i Nature , som avslöjar genuttrycksprogrammet för hela Cryptosporidiums livscykel.
Med hjälp av RNA-sekvensering profilerade forskarna mer än 9 000 parasiter – från infekterade cellkulturer och möss – och utvecklade encellsatlasen Cryptosporidium, som avslöjar vilka gener som uttrycks vid vilka punkter över hela livscykeln.
I ett andra stort fynd identifierade forskare den tidigaste bestämningsfaktorn för manlighet, en gen som kallas Myb-M.
"Vi visar i detta och annat arbete att den sexuella delen av denna livscykel är avgörande för infektion, och blockering av den genom parasitpreventivmedel kommer att blockera infektionen", säger seniorförfattaren Boris Striepen. Han säger att genom att störa sex "kan vi kanske bota sjukdomen eller försvaga parasiten för att konstruera ett vaccin, så jag tror att det finns en riktigt stark translationspotential."
Detta bygger på tidigare forskning som reviderade livscykeln till en med endast tre stadier – en enda asexuell form, män och kvinnor – medan den rådande litteraturen föreslog ytterligare ett mellanstadium.
Walzer förklarar att Cryptosporidium infekterar människor, ofta genom förorenat vatten, i en sporliknande form som kallas en oocysta, som är resistent mot vattenklorering. Väl i tarmen kommer parasiter fram från sporen för att invadera epitelcellerna som kantar tarmen och replikerar i dessa celler innan de lämnar och invaderar nya tarmceller.
Denna asexuella cykel av invasion, replikation och utträde inträffar tre gånger innan parasiterna differentierar sig till manliga och kvinnliga könsceller, och sedan leder befruktning till nya oocystor.
Walzer säger att, genom denna nya forskning, "har vi en fullständig förståelse för alla gener som är involverade i var och en av dessa processer, från invasion till tillväxt till division för att sedan bilda den invasiva formen igen."
Hon säger att den här atlasen erbjuder en detaljerad ritning av varje aspekt av parasitens biologi och dess potentiella sårbarheter. Cryptosporidium tillverkar många proteiner som är nödvändiga för att invadera och manipulera värden, och teamets arbete analyserar dessa olika proteiner baserat på tidpunkten med vilken deras gener läses.
"De invasiva formerna av parasiten kommer med ett batteri av vapen som gör att de kan invadera och passera våra celler, och denna arsenal är sammansatt med enastående tidsprecision", säger Striepen. Han jämför det med en monteringslinje för en bilfabrik där nya komponenter tillverkas precis i tid, och Walzer har tagit fram en lista över alla delar och när de kommer samman.
Walzer säger att forskare inom detta område är exalterade över Cryptosporidium-encellsatlasen eftersom de kan slå upp det sammanhang där generna de studerar uttrycks i. Detta är mycket användbar information för dem som söker efter läkemedel och vaccin, eftersom det hjälper till att förutsäga de faser av infektion där parasiten kan vara mest sårbar.
Genom att konstruera parasiter för att uttrycka fluorescens nådde forskarna också sitt andra nyckelfynd:upptäckten av transkriptionsfaktorn, vilket betyder ett protein som reglerar genuttryck, som är ansvarigt för manlighet, Myb-M.
"När vi tvingade parasiten att göra den här faktorn när som helst, blev varje parasit hane, och när vi tog bort den utvecklades inga hanar. Viktigt är att båda dessa manipulationer blockerade infektionen", säger Walzer.
Striepen säger att detta fynd understryker värdet av parasitsex som ett mål för intervention, och Walzer säger att denna studie också "leder oss upp till att känna till den kompletta katalogen av gener som krävs för parasitkön, vilket ger viktiga ledtrådar till mekanismer och translationella mål." P>
Walzer säger att hon i framtida forskning är intresserad av att följa upp hur Myb-M driver det manliga ödet och att förstå mer allmänt hur reglering av transkription driver scenspecifika skillnader för att orkestrera den komplexa livscykeln.
Mer information: Katelyn A. Walzer et al, Transcriptional control of the Cryptosporidium life cycle, Nature (2024). DOI:10.1038/s41586-024-07466-1
Journalinformation: Natur
Tillhandahålls av University of Pennsylvania