Celldelning producerar nya celler, som underbygger livsproliferation och utveckling. Mitos är den kortaste och mest dynamiska fasen i cellcykeln. Under mitos är kromosomerna jämnt fördelade mellan de två dottercellerna, vilket bevarar genomets integritet.
Centromeren, en specialiserad region av kromosomen, fungerar som en rekryteringsplattform för olika proteiner som är avgörande för att upprätthålla systerkromatidsammanhållning och för sammansättning av kinetokorer. Dessa kinetokorer är ansvariga för fästningen av spindelmikrotubuli, vilket möjliggör kromosomkongress och korrekt segregation under celldelning.
Defekter i centromerens struktur eller funktion kan leda till kromosomfelsegregering, vilket i sin tur kan resultera i genomisk instabilitet.
Bub1 (Budding Uninhibited by Benzimidazole 1) är ett serin/treoninkinas som utför olika funktioner under mitos. Det rekryteras till obundna kinetokorer under prometafas och främjar rekryteringen av andra nedströmsproteiner till kinetokorerna och centromererna.
Proteinacetylering är en konserverad posttranslationell modifiering som finns i både prokaryoter och eukaryoter. 1964 upptäckte forskare första gången acetylering av histoner. Efterföljande studier avslöjade att inte bara histoner utan även många icke-histonproteiner är föremål för acetyleringsmodifieringar, som är involverade i regleringen av olika cellulära livsaktiviteter.
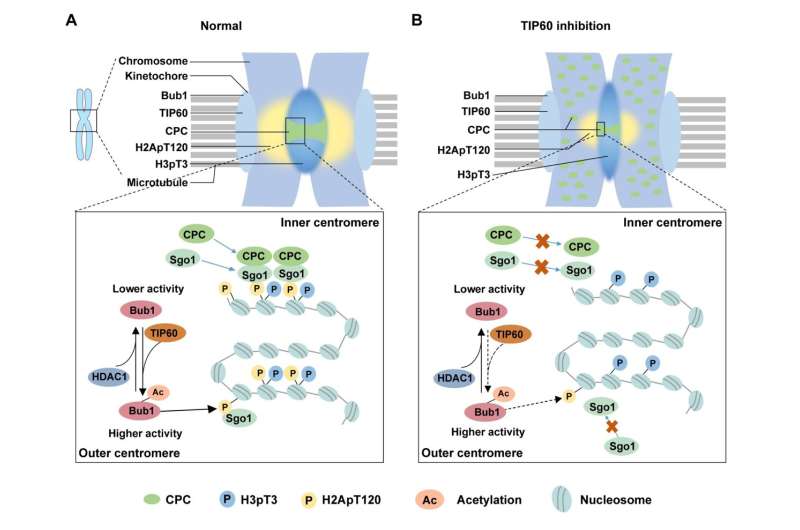
Prof. Chuanmao Zhang och kollegor vid Kunming University of Science and Technology och Peking University, har hittat en molekylär mekanism som reglerar kromosomkongress och segregation. Forskarna har visat i sin artikel publicerad i Science China Life Sciences , TIP60 acetylerar Bub1 vid K424 och K431 på kinetokorer under tidig mitos, vilket ökar kinasaktiviteten hos Bub1.
"När vi berikade de mitotiska acetylerade proteinerna upptäckte vi Bub1 bland dem", säger Mengjie Sun, den första författaren till uppsatsen. "Dessutom observerade vi en betydande ökning av acetyleringsnivån för Bub1 under tidig mitos. Detta tyder på att Bub1-acetylering kan ha en roll att spela i processen."
Detta är början på deras forskning. Och sedan, genom en serie experiment, som inkluderar levande cellavbildning och biokemiska tekniker, upptäckte de att Bub1-acetylering är avgörande för korrekt kromosomkongress och segregation. Nedsatt Bub1-acetylering orsakar en betydande fördröjning i kromosomanpassningen och defekter i kromosomsegregeringen, inklusive eftersläpande kromosomer och anafasbryggbildning.
Därefter, genom in vivo- och in vitro-experiment, bestämde de att acetyltransferas TIP60 är ansvarig för Bub1-acetyleringen.
Vidare grävde forskarna i att undersöka hur Bub1-acetylering, förmedlad av TIP60, reglerar kromosomkongress och segregation. De upptäckte effekten på rekryteringen av nedströmsproteiner till centromererna och fann att CPC-komponenterna och Sgo1 inte kunde rekryteras effektivt till centromererna när Bub1-acetyleringen avbröts.
Tidigare studier har rapporterat att Bub1 fosforylerar H2A vid T120 (H2ApT120) för att rekrytera CPC och Sgo1. Forskarna försökte sedan fastställa hur Bub1-acetylering påverkar nivån av H2ApT120. Som de förväntade sig, ökar Bub1-acetylering dess kinasaktivitet och främjar därigenom fosforyleringen av H2A.
"Detta är mekanismen genom vilken Bub1-acetylering reglerar kromosomkongress och segregation", avslutade professor Zhang.
Med tanke på att acetyleringen av Bub1 är en dynamisk process genom hela cellcykeln, syftade de också till att identifiera enzymet som ansvarar för deacetylering av Bub1. De hittade ett väsentligt deacetylas, HDAC1, som förmedlar deacetyleringen av Bub1 när celler lämnar mitos. För tidig deacetylering av Bub1 av HDAC1 kan försämra kinasaktiviteten hos Bub1 och leda till onormal demontering av centromer och kromosomfelsegregering.
"Detta bildar en acetylerings- och deacetyleringscykel av Bub1 i cellcykeln," förklarade Dr. Biying Yang.
Mer information: Mengjie Sun et al, TIP60-acetylering av Bub1 reglerar centromer H2AT120-fosforylering för trogen kromosomsegregering, Science China Life Sciences (2024). DOI:10.1007/s11427-023-2604-8
Journalinformation: Science China Life Sciences
Tillhandahålls av Science China Press