Forskare vid Leibniz Institute of Plant Biochemistry (IPB) har för första gången lyckats stabilt och exakt infoga stora gensegment i DNA från högre växter mycket effektivt. För att göra detta optimerade de genredigeringsmetoden CRISPR/Cas, allmänt känd som "genetisk sax."
Den förbättrade CRISPR-metoden erbjuder stora möjligheter för riktad modifiering av gener i högre växter, både för förädling och forskning. Studien, ledd av Prof. Alain Tissier och Dr. Tom Schreiber, har publicerats i Molecular Plant .
CRISPR/Cas är en metod med enorm potential för riktad modifiering av enskilda gener. Detta gäller dock inte alla typer av genetiska modifieringar som uppfödare och forskare har på sina önskelistor. Även om den genetiska saxen är idealisk för att slå ut gener, d.v.s. stänga av eller ta bort befintliga gener, fungerar de inte bra för att exakt infoga gener eller ersätta gensegment. Hittills har genetiska saxar varit för ineffektiva och därför till liten användning för målinriktat infogning av gener i DNA från högre växter.
"Anledningen till detta är anläggningens interna reparationsmaskineri för DNA-avbrott", säger Schreiber. Dessa reparationsenzymer är omedelbart närvarande så snart skada på DNA uppstår. De känner också igen de släta snitten som görs av den genetiska saxen och förenar omedelbart de två avskurna DNA-strängarna i dubbelhelixen. Denna sammanlimning av det skurna DNA:t sker mycket snabbt och inte särskilt exakt; det finns mindre informationsförluster där små delar av DNA försvinner eller läggs till.
"Dessa felaktigheter är inte ett problem i knock-out-projekt och är till och med önskvärda", säger Schreiber, "eftersom jag vill stänga av genen ändå. Men om jag vill infoga en gen måste det göras mycket exakt. genetisk information måste infogas exakt, inte en enda komponent får saknas och inte en enda ytterligare komponent får integreras, annars förlorar genen sin funktion och hela experimentet var förgäves."
Av denna anledning har CRISPR/Cas-medierad exakt och ärrfri infogning av större gener eller DNA-segment endast varit framgångsrik i sällsynta enskilda fall hittills. För att öka framgångsgraden för geninsättning utrustade Halle-forskarna den genetiska saxen med ett extra enzym, ett så kallat exonukleas.
Exonukleaser kan förändra de DNA-klyvningsställen som skapas av den genetiska saxen på ett sådant sätt att cellens inre reparationsenzymer inte längre kan känna igen och laga DNA-skadan. DNA-segmentet som ska infogas av CRISPR/Cas skulle därför ha tillräckligt med tid för att integrera sig i rätt position genom en annan, mycket exakt, cellulär reparationsmekanism.
I experimentet testade Halle-forskarna olika exonukleaser av viralt, bakteriellt, växt- och mänskligt ursprung för deras förmåga att öka antalet exakta geninsättningshändelser. De introducerade den genetiska saxen med motsvarande exonukleaser och ett gen X-segment i bladcellerna hos tobaksväxten Nicotiana benthamiana.
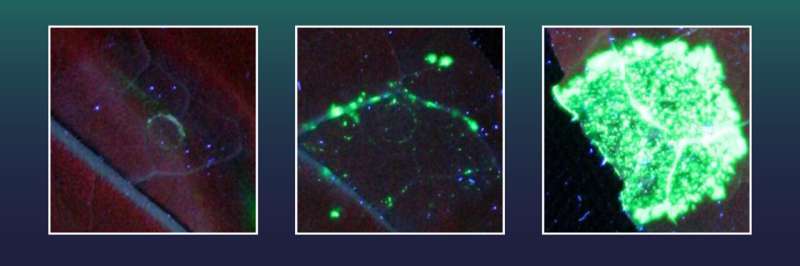
Dessa tobaksceller hade tidigare utrustats med en gen för en grön fluorescerande markör. De innehöll också en förstörd gen X, som krävs för bildandet av det gröna fluorescerande färgämnet. Den fluorescerande markören kan dock inte genereras så länge som en stor del av gen X:s genetiska information saknas.
Den gröna markören kan bara produceras när den saknade gensektionen av X är exakt återinsatt med CRISPR/Cas, och på så sätt reparerar gen X. Varje cell med framgångsrik geninsättning kommer sedan att fluorescera i grönt och forskare kan helt enkelt räkna frekvensen av framgångsrika geninfogningshändelser .
Två av de testade exonukleaserna, inklusive en från herpesvirusfamiljen, visade sig vara särskilt effektiva. Med hjälp av dessa uppnådde teamet från Halle 38 gånger fler perfekta geninfogningshändelser än med enbart CRISPR/Cas.
Detta experimentella tillvägagångssätt testades sedan med andra gener som skulle inkorporeras och i andra växter, nämligen krasse (Arabidopsis thaliana) och vete. Eftersom geninsättningen i tobaksväxterna endast skedde lokalt i bladen, förlorades den integrerade genen i nästa dottergeneration och fanns därför endast i arvsmassan under en begränsad tid.
Det är därför som Halle CRISPR-experterna i Arabidopsis och vete försökte införliva genen i könsceller för att säkerställa ett stabilt arv till framtida växtgenerationer. Med hjälp av de testade exonukleaserna visade sig den stabila, det vill säga ärftliga, knock-in av gener framgångsrik i Arabidopsis med en tiofaldig ökning i frekvens och i vete i mer än 1 % av dotterplantorna.
"En procent låter inte så mycket till en början", förklarar Schreiber, "men om en uppfödare vill introducera en viss egenskap i sin växt skulle han bara behöva screena runt 50–100 första generationens dotterplantor med vår optimerade CRISPR /Cas-metoden för att hitta en växt med den önskade egenskapen. Detta skulle spara avsevärd tid jämfört med konventionella förädlingsmetoder, där 500 till 1 000 växter skulle behöva analyseras för detta ändamål."
Därför är den optimerade CRISPR/Cas-metoden ett lovande verktyg för riktat införande av gener i högre växter och möjligen även i andra organismer. I framtiden skulle växtförädlare kunna använda den här metoden för att till exempel återinföra förlorade resistensgener mot patogener från vilda arter eller gamla odlade sorter i moderna, högavkastande elitsorter. På så sätt kan önskvärda egenskaper som dessa förbättra växtförädlingen och bidra till utvecklingen av mer robusta grödor.
För vetenskapen erbjuder detta tillvägagångssätt stora möjligheter att elegant ersätta vissa växtgener med modifierade kopior av sig själva i ett enda steg. Detta är särskilt användbart för att klargöra genens funktion.
Mer information: Tom Schreiber et al., Effektiv ärrfri knock-ins av flera kilobaser i växter av konstruerade CRISPR-Cas-endonukleaser, Molecular Plant (2024). DOI:10.1016/j.molp.2024.03.013
Journalinformation: Molekylär växt
Tillhandahålls av Institut für Pflanzenbiochemie