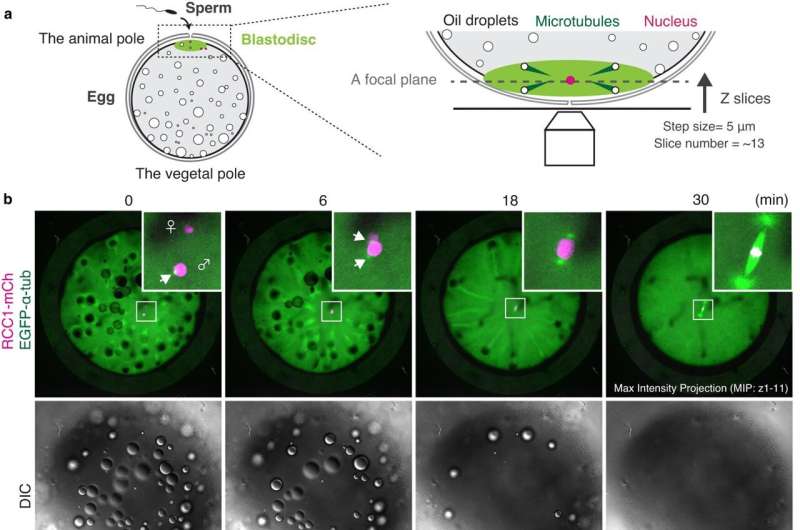
Livets början är höljd i mystik. Även om mitosens invecklade dynamik är väl studerad i de så kallade somatiska cellerna - de celler som har en specialiserad funktion, som hud- och muskelceller - förblir de svårfångade i de första cellerna i våra kroppar, de embryonala cellerna. Embryonal mitos är notoriskt svårt att studera hos ryggradsdjur, eftersom levande funktionella analyser och avbildning av experimentella embryon är tekniskt begränsade, vilket gör det svårt att spåra celler under embryogenes.
Men forskare från Cell Division Dynamics Unit vid Okinawa Institute of Science and Technology (OIST) har publicerat en artikel i Nature Communications , tillsammans med professorerna Toshiya Nishimura från Hokkaido University (tidigare vid Nagoya University), Minoru Tanaka från Nagoya University, Satoshi Ansai från Tohoku University (för närvarande vid Kyoto University), och Masato T. Kanemaki från National Institute of Genetics.
Studien tar de första stora stegen mot att svara på frågor om embryonal mitos, tack vare en kombination av nya avbildningstekniker, CRISPR/Cas9-genomredigeringsteknik, ett modernt protein-knockdown-system och medaka eller japansk risfisk (Oryzias latipes).
Timelapses som de har producerat hjälper till att svara på grundläggande frågor om den komplicerade processen att dela kromosomerna lika under embryonal mitos, och kartlägger samtidigt nästa gräns för vetenskaplig utforskning. Som professor Tomomi Kiyomitsu, senior författare till studien, beskriver timelapses och säger:"De är vackra, både på egen hand och för att de lägger en ny grund för att belysa embryonal mitos."
Centralt i mysteriet med embryonal mitos är det avgörande steget när kromosomerna, som innehåller all genetisk information från cellen, är anpassade och segregerade lika till dotterceller. En nyckelspelare i denna process är den mitotiska spindeln, som är gjord av mikrotubuli – långa proteinfibrer som används för intracellulär struktur och transport – som strålar ut från spindelns motsatta poler och fäster vid kromosomerna i mitten. Spindeln fångar duplicerade kromosomer ordentligt och segregerar dem lika i dottercellerna under delning.
Det finns många faktorer som bestämmer spindelbildningen, och en av dessa är proteinet Ran-GTP, som spelar en viktig roll i celldelningen av kvinnliga reproduktionsceller, som saknar centrosomer - cellorganeller som ansvarar för att montera mikrotubuli - men inte i små somatiska celler, som har centrosomer. Det har dock länge varit oklart om Ran-GTP krävs för spindelsammansättning i tidiga embryon från ryggradsdjur, som innehåller centrosomer men har unika egenskaper, som en större cellstorlek.
I motsats till tidiga embryon från däggdjur är embryonala celler i fisk genomskinliga och utvecklas synkront i ett enhetligt encellsskikt, vilket gör dem betydligt lättare att spåra. Medakan visade sig vara särskilt väl lämpad för forskarna, eftersom dessa fiskar tål ett brett temperaturområde, producerar ägg dagligen och har ett relativt litet arvsmassa.
Att vara temperaturtolerant betyder att medaka embryonala celler kan överleva vid rumstemperatur, vilket gör dem särskilt lämpade för långa, levande timelapse-fotografering.
Det faktum att medaka producerar ägg ofta och har en relativt liten genomstorlek gör dem till goda kandidater för CRISPR/Cas9-medierad genomredigering. Med denna teknik har forskarna skapat genetiskt modifierade eller transgena medaka vars embryonala celler bokstavligen belyser dynamiken hos vissa proteiner som är involverade i mitos.
När forskarna studerade timelapses av den utvecklande mitotiska spindeln i levande, transgena medaka-embryon, upptäckte forskarna att stora tidiga embryon sätter ihop unika spindlar som skiljer sig från somatiska spindlar. Dessutom spelar Ran-GTP en avgörande roll för spindelbildning vid tidiga embryonala divisioner, men betydelsen minskar i embryon i senare skede. Detta beror möjligen på att spindelstrukturen görs om när cellerna blir mindre under utvecklingen, även om den exakta orsaken är ett ämne för framtida forskning.
Forskarna upptäckte också att de tidiga embryonala cellerna inte har en dedikerad kontrollpunkt för spindelsammansättning, som kännetecknar de flesta somatiska celler, och som tjänar till att säkerställa att kromosomerna är korrekt inriktade före segregering.
Som professor Kiyomitsu säger:"Kontrollpunkten är inte aktiv, och ändå är kromosomsegregationerna fortfarande mycket exakta. Detta kan förklaras av att embryonala celler behöver dela sig väldigt snabbt, men det är något som vi vill studera vidare."
Även om genetisk modifiering av medaka-fisken och studier av de tidiga embryona har lett till nya nyckelinsikter om embryonal mitos, är detta bara början för professor Kiyomitsu och teamet.
Förutom frågor relaterade till Ran-GTP:s minskande roll i senare skeden och kontrollpunkten för den saknade spindelsammansättningen, pekar han på den tillfredsställande symmetrin av celldelningar i timelapses. "Spindelbildningen kännetecknas av en hög grad av symmetri, eftersom cellerna ser ut att dela sig i storlekarna och definierade riktningar, och spindeln är konsekvent i mitten av cellerna. Hur kan spindeln orientera sig så regelbundet över cellerna , och hur kan den hitta centret varje gång?"
Utöver tidsförloppen hoppas teamet också att ytterligare solidifiera denna nya grund med ytterligare medaka-genlinjer för att fungera som modeller för forskning i embryonala celler, och samtidigt optimera genomredigeringsprocessen.
Så småningom vill teamet testa för generaliserbarhet av sina fynd genom att studera embryonal mitos i andra organismer, och i ett senare skede vill de utforska utvecklingen av spindelsammansättning och embryonala divisioner, vilket också skulle bidra till en bättre förståelse av mänsklig embryogenes och att utveckla diagnos och behandling av mänsklig infertilitet.
"Med den här uppsatsen har vi skapat en solid grund", säger professor Kiyomitsu, "men vi har också öppnat en ny gräns. Embryonal mitos är vackert, mystiskt och utmanande att studera, och vi hoppas att vi med vårt arbete så småningom kan komma lite närmare att förstå de invecklade processerna i början av livet."
Mer information: Ai Kiyomitsu et al, Ran-GTP monterar en specialiserad spindelstruktur för exakt kromosomsegregation i medaka tidiga embryon, Nature Communications (2024). DOI:10.1038/s41467-024-45251-w
Journalinformation: Nature Communications
Tillhandahålls av Okinawa Institute of Science and Technology