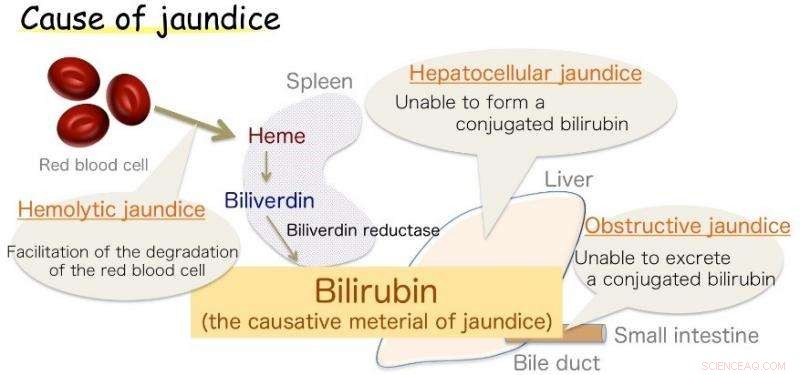
Bild 1:Orsak till gulsot. Bilirubin är det orsakande materialet för gulsot. Upphovsman:Osaka University
Ett japanskt forskargrupp som involverade Osaka University undersökte biliverdinreduktas, enzymet som producerar bilirubin - ett ämne kopplat till gulsot - från biliverdin (BV). Två BV -molekyler hittades vid enzymreaktionsstället, i ett ovanligt staplat arrangemang. Mutationsexperiment bekräftade vilket enzym aminosyra som var nödvändigt för bilirubinproduktion. I den föreslagna mekanismen, denna aminosyra överför väte till en BV -molekyl, använder den andra BV som en kanal. Detta hjälper till att leta efter läkemedel mot gulsot.
Osaka - gulsot, markerad med gulning av huden, är vanligt hos spädbarn, men också ett symptom på olika vuxnasjukdomar. Denna missfärgning orsakas av överskott av bilirubin (BR), ämnet som ger gallan dess gula nyans. Dock, BR är också en vital antioxidant, som vid friska nivåer skyddar cellerna mot peroxidskador. Dess produktion i kroppen, fastän, har länge varit en källa till osäkerhet.
Nu, ett japanskt forskningssamarbete som involverar Osaka University tror att det har svaret. BR är redan känt för att vara framställt av en relaterad kemikalie, biliverdin (BV), av enzymet biliverdin reduktas (BVR). Enzymet sveper runt BV och överför två väteatomer - en positiv och en negativ - för att producera den gula antioxidanten. Dock, biologer kunde inte fastställa vilken del av enzymet som var kemiskt involverad i processen (den aktiva platsen), eller varifrån det positiva vätet kom. Resultaten rapporterades nyligen i Naturkommunikation .
"Tidigare studier använde BVR från råttor, och kunde aldrig kristallisera enzymet tillräckligt bra för att bestämma hur det binder till BV, "säger medförfattare i studien Keiichi Fukuyama." Vi insåg att samma enzym i Synechocystis-bakterier hade en nästan identisk veckform, men var lättare att undersöka med röntgenkristallografi. "
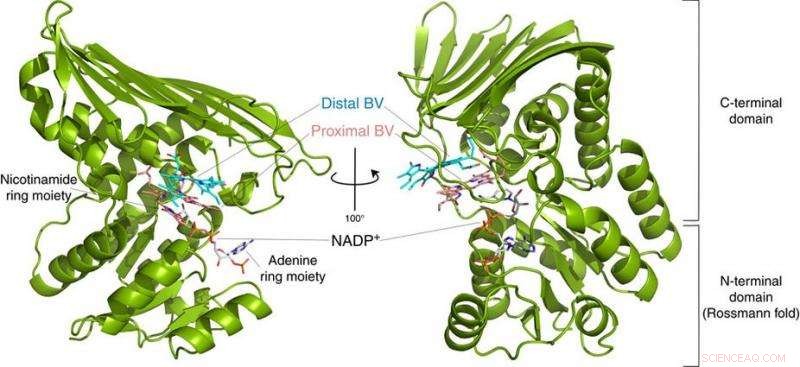
Fig.2:Struktur för BVR. Denna struktur avslöjade att BVR binder två biliverdinsubstrat (Distal BV och Proximal BV) samtidigt. Upphovsman:Osaka University
Till deras förvåning, forskarna hittade två molekyler BV - en staplad på den andra - på den aktiva platsen, även om bara en konverteras till BR. Från röntgendata, de kom fram till varför två behövdes. Den första BV, på grund av den riktning den vetter mot att ta emot det negativa vätet, kan inte ta emot det positiva vätet direkt från enzymet. Istället, den andra BV fungerar som en vätgasledning för att möjliggöra processen, men konverteras inte i sig till BR.
Från strukturen, forskarna föreslog vilken av enzymets 328 aminosyror som faktiskt ger den positiva väteatomen. Sedan, de utförde experiment där enzymerna muterades för att specifikt ta bort den aminosyran, samtidigt som de andra är intakta. De resulterande enzymerna, från bakterier, råttor, eller människor, var praktiskt taget oförmögna att producera BR. Ytterligare experiment bekräftade att råtta och humana enzymer också använde två BV -molekyler, precis som bakterierna.
"En sådan snygg stapling av två substratmolekyler under enzymatiska processer är mycket sällsynt, "Fukuyama säger." En bättre förståelse av BR -produktion är inte bara spännande för biokemi, men ska hjälpa oss att utveckla läkemedel mot sjukdomar som präglas av svår gulsot från överskott av BR, såsom hepatit. "
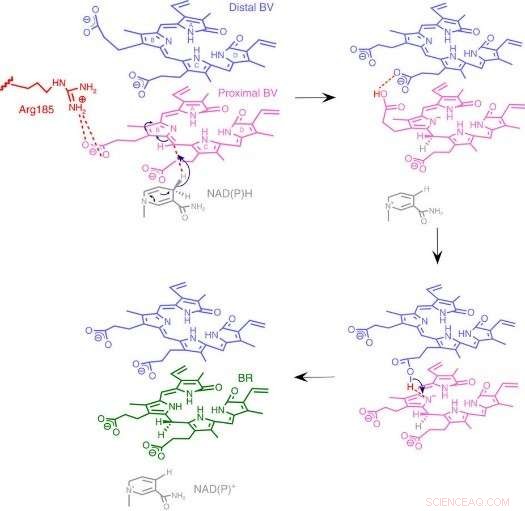
Fig.3:Mekanism för BVR -reaktionen. Vi föreslår en unik reaktionsmekanism baserad på en ny enzymstruktur där två staplade substrat binder till en katalytisk ficka. Upphovsman:Osaka University