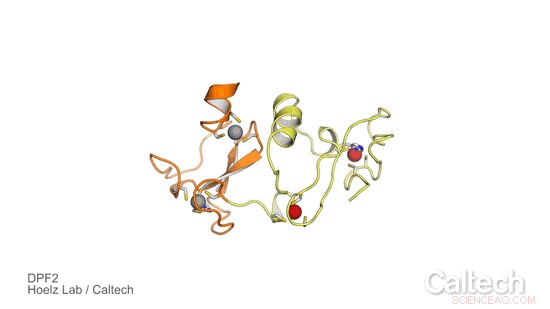
En kristallstruktur av en del av mänskligt DPF2, ett protein som styr en genetisk switch som talar om för blodstamceller när de ska bli röda och vita blodkroppar. Orange och gula områden illustrerar DPF2-läsardomänen, som stabiliseras av zinkjoner, representeras som röda och gråa sfärer. Kredit:Hoelz Lab/Caltech
Många saker går fel i cellerna under utvecklingen av cancer. I hjärtat av kaoset är ofta genetiska växlar som styr produktionen av nya celler. I en särskilt aggressiv form av leukemi, kallas akut myeloid leukemi, en genetisk switch som reglerar mognaden av blodstamceller till röda och vita blodkroppar går snett. I vanliga fall, denna växling leder till lämpligt antal vita och röda blodkroppar. Men patienter med akut myeloisk leukemi slutar med en farlig ansamling av blodstamceller och brist på röda och vita blodkroppar - celler som behövs för att förse kroppen med syre och bekämpa infektioner.
Nu, forskare vid Caltech och Sylvester Comprehensive Cancer Center vid University of Miami håller på att ta itu med ett protein som hjälper till att kontrollera denna genetiska switch. Hos friska individer, proteinet, kallas DPF2, stoppar produktionen av röda och vita blodkroppar när de inte behöver bytas ut. Det är, det stänger av strömbrytaren. Men proteinet kan överproduceras hos patienter med akut myeloid leukemi. Proteinet sitter i princip på strömbrytaren, hindrar den från att slå på igen för att göra blodkropparna efter behov. Patienter som överproducerar DPF2 har en särskilt dålig prognos.
I en ny studie, publiceras veckan den 22 maj, 2017, i journalen Proceedings of the National Academy of Sciences , forskarna visar nya sätt att hindra DPF2, vilket möjligen gör akut myeloid leukemi mer behandlingsbar. De rapporterar nya strukturella och funktionella detaljer om ett fragment av DPF2. Denna nya information avslöjar mål för utvecklingen av läkemedel som skulle blockera proteinets funktion.
"Många mänskliga sjukdomar, inklusive cancer, uppstår på grund av felaktiga genetiska växlar, säger André Hoelz, motsvarande författare till studien. Hoelz är professor i kemi vid Caltech, en Heritage Medical Research Institute (HMRI) utredare, och en Howard Hughes Medical Institute (HHMI) fakultetsforskare. "Att förtydliga hur de fungerar med atomdetaljer gör att vi kan börja processen med att skräddarsy läkemedel för att inaktivera dem och i många fall är det ett viktigt steg mot ett botemedel."
Röda och vita blodkroppar regenereras ständigt från blodstamceller, som finns i vår benmärg. Precis som andra stamceller, blodstamceller kan leva för evigt. Det är först när de blir differentierade till specifika celltyper, som röda och vita blodkroppar, att de sedan blir dödliga, eller förvärva förmågan att dö efter en viss tid.
"Våra kroppar använder en komplex serie av genetiska växlar för att differentiera en blodstamcell till många olika celltyper. Dessa differentierade celler cirkulerar sedan i blodet och fyller en mängd olika funktioner. När dessa celler når slutet av sin livslängd måste de bli ersatt, "säger Hoelz." Det här är ungefär som att byta ut begagnade däck på en bil. "
För att undersöka rollen av DPF2 och lära dig mer om hur det styr den genetiska omkopplaren för att göra blodkroppar, Hoelz-gruppen samarbetade med Stephen D. Nimer, med motsvarande författare till tidningen och chef för Sylvester Comprehensive Cancer Center, och hans team. Först, Ferdinand Huber och Andrew Davenport – båda doktorander vid Caltech i Hoelz-gruppen och medförfattare till den nya studien – fick kristaller av en del av DPF2-proteinet som innehöll en domän som kallas ett PHD-finger, som står för planet homeodomain. De använde sedan röntgenkristallografi, en process som involverar att utsätta proteinkristaller för högenergiröntgenstrålar, för att lösa strukturen för PHD-fingerdomänen. Tekniken utfördes vid Stanford Synchrotron Radiation Lightsource, med hjälp av en dedikerad strållinje från Caltechs Molecular Observatory.
Resultaten avslöjade hur DPF2 binder till ett DNA-proteinkomplex, kallas nukleosomen, att blockera produktionen av röda och vita blodkroppar. Proteinet "läser" olika signaler som visas på nukleosomytan genom att anta en form som passar olika modifieringar på nukleosomkomplexet, som de olika formade bitarna i ett pussel. När proteinet binder till detta DNA-lokus, DPF2 stänger av strömbrytaren som reglerar blodcellsdifferentiering.
Nästa steg var att se om DPF2 kunde blockeras i mänskliga blodstamceller i labbet. Sarah Greenblatt, en postdoktor i Nimers grupp och medförfattare till studien, använde den strukturella informationen från Hoelz grupp för att skapa en muterad version av proteinet. Nimer-gruppen introducerade sedan det muterade proteinet i blodstamceller, och fann att den muterade DPF2 inte längre kunde binda till nukleosomen. Med andra ord, DPF2 kunde inte längre inaktivera omkopplaren för att göra blodceller.
"Den muterade DPF2 kunde inte binda till specifika regioner i genomet och kunde inte stoppa blodstamcellsdifferentiering, ", säger Huber. "Om DPF2 också kan blockeras hos cancerpatienterna själva återstår att se." Forskarna säger en strukturell socket i DPF2, en av de pusselbitliknande regionerna som identifierades i den nya studien, är ett bra mål för läkemedelskandidater.