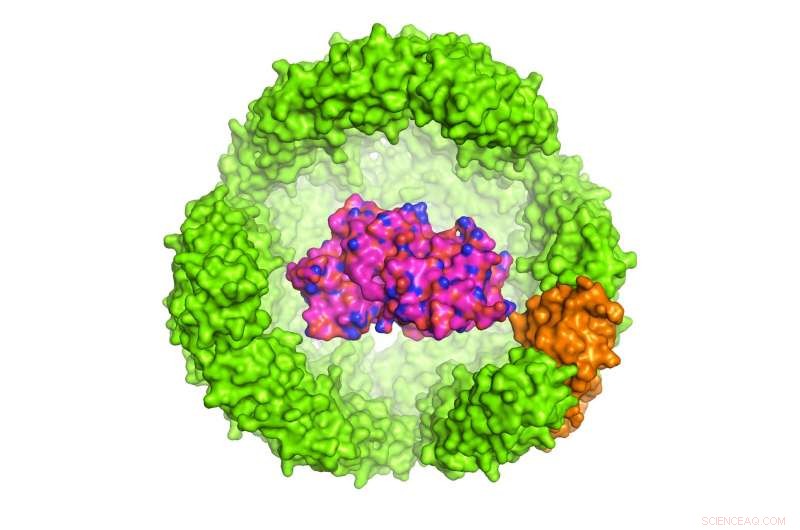
Illustration av ett protein av intresse (POI) inuti en 24-subenhet Archeoglobus fulgidus ferritin exoshell, som är 12 nanometer i diameter (endast hälften av skalet visas). Upphovsman:Dr Chester L. Trumma
Ett team från NUS Yong Loo Lin School of Medicine (NUS Medicine) har uppfunnit ett grundläggande nytt sätt att vika och skydda rekombinanta proteiner. Hämtat från det snabbt växande området syntetisk biologi, denna protein-i-ett-protein-teknik kan förbättra funktionella proteinutbyten med 100 gånger och skydda rekombinanta proteiner från värme, hårda kemikalier och proteolys.
Uttrycket och stabiliseringen av rekombinanta proteiner är hörnstenen i den biologiska och farmaceutiska industrin. Kostnaderna och komplexiteten i samband med tillverkning av svårvikbara rekombinanta proteiner i industriell skala är en betydande begränsande faktor för deras användning i kliniska och industriella tillämpningar.
Studien ledd av Dr Chester Drum, Docent vid institutionerna för medicin och biokemi, NUS Medicine publicerades i tidskriften Naturkommunikation den 13 november 2017. Dr Drum och kollegor konstruerade en exoshell med en diameter på 12 nanometer och lindade den runt ett intressant protein (POI). De visade för första gången att denna teknik kan användas för att vika och skydda en mängd proteiner i konstruerade håligheter som är mindre än 1:10, 000 bredden på ett människohår.
Forskarna utvecklade denna protein-in-a-protein-teknik med hjälp av Archeoglobus fulgidus, en härdig bakterie som naturligt finns i hydrotermiska ventiler. Dessa hypertermofila bakterier har utvecklat unika lösningar för proteinfällning och stabilisering på grund av de extrema miljöer de lever i.
Särskilt, forskarna använde ett järnbärande, 24-subenhetsprotein i A. fulgidus kallat ferritin, vars naturliga funktion är att lagra och bära järn i blodet. Ferritin från A. fulgidus har två unika egenskaper:för det första, fyra små porer i skalet ger små molekyler tillgång till hålrummet; andra, till skillnad från humant ferritin som är stabilt vid låga saltkoncentrationer, det konstruerade A. fulgidus ferritin dissocierar vid låga saltkoncentrationer, tillåter innehållet i hålrummet att frigöras med en enkel pH -omkopplare från 8,0 till 5,8. När det väl är dissocierat, POI kan frigöras enzymatiskt.
För att demonstrera den stora mångsidigheten i deras teknik, forskarna testade sin exoshell -teknik genom att smälta ihop en av de 24 ferritinunderenheterna kring tre intressepunkter med olika egenskaper - grönt fluorescerande protein, pepparrotsperoxidas (HRP) och Renilla luciferas.
Exoshell hjälpte inte bara till att öka avkastningen för alla tre intressanta platser, forskarna kunde också leverera kofaktorer hem och kalcium, förutom oxiderande förhållanden, för att säkerställa att komplexa intressepunkter som HRP -protein kan vikas och fungera korrekt.
Förutom att hjälpa till att vika POI:erna korrekt, exoshells var också skyddande mot ett brett spektrum av denaturanter, inklusive trypsin med hög koncentration; organiska lösningsmedel, såsom acetonitril och metanol; och denaturanter såsom urea, guanidin saltsyra, och värme.
"Vi antar att den signifikanta ökningen i funktionellt proteinutbyte kan bero på komplementet mellan de negativt laddade proteinerna och den positivt laddade exoshell-ytan. Våra fynd belyser potentialen med att använda högkonstruerade nanometerstora skal som ett syntetiskt biologiskt verktyg för att dramatiskt påverka produktionen och stabiliteten av rekombinanta proteiner, "sa Dr Drum, som också är konsultkardiolog vid National University Hospital och chef för Clinical Trial Innovation Lab på TLGM, EN STJÄRNA.
Rekryterades till National University of Singapore 2011, han har sedan fått finansiering från Singapore MIT Alliance för forskning och teknik, National Medical Research Council, Biomedicinsk forskningsråd, A*STAR och NUS Medicine.
Dr Drums nuvarande forskning överbryggar klyftan mellan grundläggande biokemi och klinisk vård. Han är för närvarande den primära utredaren på ett multinstitutionellt, 3, 000-personers observationsstudie i Singapore som studerar hur personlig läkemedelsmetabolism påverkar läkemedelssvar.